Поглинання світла внаслідок перенесення заряду в молекулярних орбіталях
На одній молекулярній орбіталі, що об’єднує іон перехідного металу і ліганд, електронні переходи можуть здійснюватися між незв’язуючими t2u (π) і t1u (π)–орбіталями і незаповненими антизв’язуючими орбіталями t2g (π*) і eg(σ*) (рис. 10.24). Так як орбіталі t2u (π) і t1u (π) в значній мірі є лігандними орбіталями, а t2g (π*) і eg(σ*) –орбіталі належать переважно іону металу, то в результаті електронних переходів між такими орбіталями здійснюється перерозподіл електронної густини – перенесення заряду («осциляція» валентності) від ліганду до металу.
Перенесення заряду відбувається тоді, коли електрон під дією випромінювання переходить із незв’язуючої орбіталі, що повністю сконцентрована коло одного із атомів, на антизв’язуючу орбіталь, що повністю належить іншому атому; при цьому поглинається певна енергія.Залучені до таких переходів електрони вважаються такими, що розміщені одночасно на різних рівнях сусідніх атомів.
| Таблиця 10.7. Мінерали із виразно забарвленими рисами | ||
| Мінерал | Формула | Риса |
| Сфалерит | Zn0.99Fe0.01S | світло-жовта |
| Сфалерит | Zn0.97Fe0.03S | червонувато-коричнева |
| Сфалерит | Zn0.9Fe0.1S | темно-коричнева |
| Грінокіт | CdS | жовта |
| Аурипігмент | As2S3 | жовта |
| Реальгар | As4S4 | червоно-оранжева |
| Ґетит | FeOOH | оранжево-коричнева |
| Кіновар | HgS | червона |
| Гематит | Fe2O3 | темно-червона |
| Рутил | TiO2 | жовта до світло-коричневої |
| Піраргірит | Ag3SbS3 | багряно-червона |
| Полібазит | Ag16Sb2S11 | темно-червона до чорної |
| Вольфраміт | Fe0.05Mn0.95WO4 | жовтувато-коричнева |
| Вольфраміт | Fe0.95Mn0.05WO4 | темно-коричнева до чорної |
| Еритрин | Co3[AsO4]2(H2O)8 | світло-рожева |
| Азурит | Cu3[CO3]2(OH)2 | синя |
| Малахіт | Cu2[CO3](OH)2 | зелена |
Смуги поглинання в оптичних спектрах, що утворюються внаслідок перенесення заряду мають значно більшу інтенсивність ніж смуги поглинання кристалічного поля (d – d-переходів).
Особливості поглинання енергії світлового спектру залежать від того, між якими атомами здійснюється перенесення заряду. Можливі наступні варіанти:
1. Електронні переходи між катіонами металу і аніонами за схемою ліганд à метал в комплексів із лігандами O2- (Fe3+↔O2-, Ti4+↔O2-, Mn4+↔ O2-), S2- (Fe2+ ↔ S2-), Se2-, F–, Cl-. Кожний валентний стан катіону в різних координаціях дає якісно різні спектри: а зміна ліганду та викривлення координаційного поліедру призводить до зміщення та розщеплення смуг поглинання.
2. Електронні переходи між між різновалентними іонами металу (Fe2+↔Fe3+, Mn2+↔Mn3+↔Mn4+), що займають сусідні координаційні поліедри; перенесеня заряду в цьому випадку супроводжується «тимчасовою» зміною валентності в момент збудження електронів квантами певної енергії.
Енергія смуг перенесення заряду (при інших однакових умовах) зменшується із зменшенням віддалі кисень–метал. Для металу в октаедричній координації енергія смуг перенесення більша, ніж в тетраедричній координації.
Спектри перенесення заряду спостерігаються для всіх іонів перехідних металів, в тому числі тих, що не дають спектрів кристалічного поля, але для більшості із них смуга поглинання знаходиться у ультрафіолетовій області і не впливає на забарвлення.
Розглянемо формування спектрів поглинання в оксидів титану TiO2 – рутилу та анатазу. Титан знаходиться в цих мінералах у вигляді Ti4+. Цей іон не має d–електронів, його електронні рівні не розщеплюються у кристалічному полі. Перенесення заряду Ti4+↔O2- створює край поглинання із максимумом в ультрафіолетовій області, що відповідає енергії перенесення 3.7 еВ(=335 нм) в анатазі і 3.3 еВ (=376 нм) в рутилу (рис. 10.22). Саме тому у чистого стехіометричного TiO2 немає смуг поглинання у видимій області. В природі безбарвний рутил є рідкістю. Звичайно він інтенсивно поглинає світло і є напівпрозорим або непрозорим. Таке поглинання спричинене накладенням інших факторів, таких як поглинання в кристалічному полі домішкових іонів Fe3+, Cr3+, або ж поглинання електронно-діркових центрів, поява яких пов’язана із відхиленнями від стехіометрії із формуванням вакансій кисню. Викликані цими факторами смуги поглинання накладаються на край поглинання, зумовлюючи його зміщення в довгохвильову область.
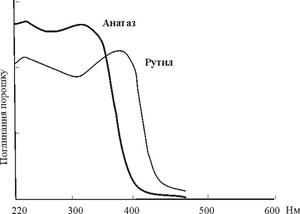
|
| Рис. 10.22. Короткохвильовий край поглинання на спектрах рутилу та анатазу, зумовлений перенесенням заряду Ti4+↔O2-. |
Широко поширеним є інтенсивне поглинання, спричинене перенесення заряду між іонами перехідних металів і киснем. Цей механізм є основним хромоформним фактором в оксидах із Fe3+. Під впливом фотону світла електрон із зв’язуючої орбіталі. що ближче до O2, переходить на незв’язуючу орбіталь, опиняючись на орбіталі, що належить Fe3+. Максимум смуги перенесення заряду Fe3+ ↔ O2- припадає на ультрафіолетову область (230–250нм), але інтенсивність поглинання настільки велика, що навіть хвіст смуги перенесення заряду, що попадає у видиму, а, при великих вмістах Fe3+ , і в інфрачервону область (рис. 10.23), вирішальним чином впливає на забарвлення мінералів. Інші, більш слабші, смуги поглинання спектру кристалічного поля зникають у ній.
Іони Ti4+ і Fe2+ у структурі корунду, кожний сам по собі, не викликають забарвлення, так як енергетична щілина між стабільним і збудженим станами перевищує енергії «видимого фотону». Але якщо вони опиняються в сусідніх позиціях, то можуть діяти кооперовано. Приймемо, що в початковому, стабільному, стані в двох октаедричних позиціях, зв’язаних між собою гранями, існували Ti4+ і Fe2+ (рис. 10.24). Невелика віддаль між іонами металів (2.65 Å) спричинює перекривання їх незв’язуючих орбіталей. Завдяки цьому, електрони можуть переходити від одного атома до другого. Енергія, необхідна для цього переходу, невелика, співрозмірна із енергією «червоного» фотону. Поглинаючи такий фотон, електрон від Fe2+ переходить до Ti4+ і утворюється нова конфігурація Ti3+ і Fe3+. У цьому випадку поглинається червона частина спектру, а залишкове світло, що проходить через мінерал надає йому синього забарвлення.
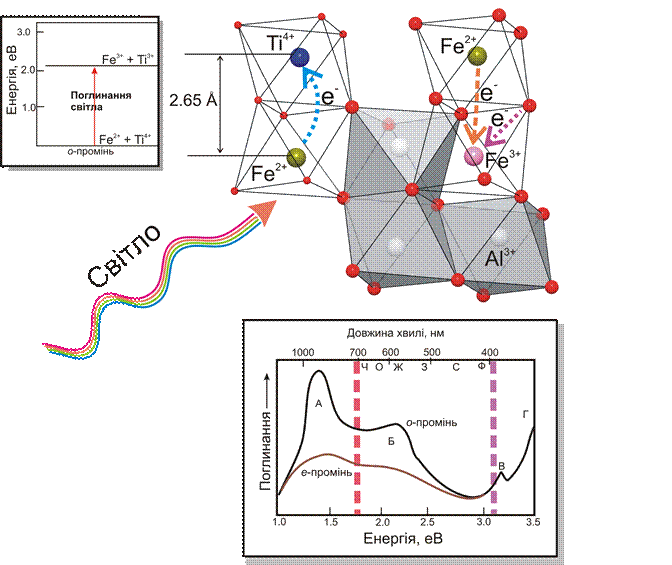
Рис. 10.24. Схема, що ілюструє механізм перенесення заряду в молекулярній орбіталі Fe2+ – Ti4+ в структурі корунду. На верхній лівій врізці показано енергетичні рівні, між якими відбувається перенесення електрону. На нижній врізці зображено спектри поглинання для звичайного та незвичного променів у корунді. Відмінність в інтенсивності та будові спектрів поглинання для е- і о- променів спричинює зміну поглинання і результуючого забарвлення залежно від кристалографічної орієнтації мінералу (плеохроїзім мінералу).
На рисунку показана присутність різних механізмів поглинання світла в одному мінералі. Смуга поглинання А у ближньому інфрачервоному діапазоні відповідає перенесенню заряду Fe2+-↔Fe3+, смуга Б в червоному діапазоні зумовлена перенесенням зарядуFe2+ ↔ Ti4+, смуга В в ультрафіолетовому діапазоні спричинена поглинанням кристалічного поля іону Fe3+ , і смуга Г – перенесенням заряду O2-↔Fe3+ (За G. Lehman and H. Harder, Am. Mineral 55, 98 (1970)).
Процес перенесення заряду відбувається приблизно за фемтосекунду (10-15сек). У збудженому стані система нестабільна і прагне повернутися у стабільний стан. Цей процес – релаксація – самовільний, спонтанний. Він відбувається за 10-10 секунд, тобто майже в мільйон раз довше, ніж збудження.
Інтенсивність поглинання залежить від орієнтації вектору електричного поля світла відносно орієнтації зв’язку М–О, що проявляється у виразному плеохроїзмі мінералів із комплексами із перехідними металам. Смуга перенесення також стає дихроїчною при пониженні локальної симетрії кристалохімічної позиції (викривленні координаційного поліедру), і саме цим зумовлена дихроїчність забарвлення біотитів, піроксенів, турмалінів.
Знаходження в сусідніх тісно зв’язаних позиціях різновалентних катіонів одного металу також може спричинити перенесення заряду М → М. Найбільш поширеними є пара [Fe2+ + Fe3+] в сусідніх координаційних поліедрах, що мають спільні ребро або грань. Тоді виникає можливість перекриття d-орбіталей Fe2+ і Fe3+. Можлива і взаємодія між ними і через орбіталі ліганда.
Поглинання, зумовлене перенесенням заряду Fe2+ ↔ Fe3+, максимально проявлене в магнетиту, де такий механізм поглинання світла спричинює повну непрозорість мінералу. Структура мінералу поглинає 80% світла, що падає на мінерал. Перенесення заряду в цій парі зумовлює смуги поглинання у червоному діапазоні ряду мінералів (берил, турмаліни), в яких може бути присутня ізоморфна домішка двох катіонів.
Перенесення заряду можливе також в парах іонів Ti3+ – Ti4+ та Fe3+ – Ti4+, якщо вони знаходяться в сусідніх поліедрах, що проявляється на спектрі як смуга поглинання в області 20000 – 24000 см-1.
Для здійснення перенесення заряду потрібно, щоб вектор світлових коливань 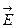 був направлений вздовж зв’язку М – М. Це відображається у виразній залежності інтенсивності поглинання від взаємної орієнтації світлового променя і кристалу. Мінерали, в яких поглинання спричинене поглинанням заряду в парі М → М, мають виразний плеохроїзм.
був направлений вздовж зв’язку М – М. Це відображається у виразній залежності інтенсивності поглинання від взаємної орієнтації світлового променя і кристалу. Мінерали, в яких поглинання спричинене поглинанням заряду в парі М → М, мають виразний плеохроїзм.
Дата добавления: 2015-05-21; просмотров: 1219;
