Формирование состава вод в условиях эпигенеза
Хлоридно кальциевые и магниевые рассолы.
Воды, которые более концентрированы, чем морская вода, так называемые рассолы, повсеместны на больших глубинах. Пример концентраций Na+ vs. Cl- в поровых водах Юры, Мела и третичных отложений на территории Галф Гост показана на рисунке 10. Жирная линия на этом рисунке показывает тенденцию испарения морской воды; концентрации Na+ и Cl- совместно пока не наступит насыщение галитом (NaCl). Затем концентрация Cl- продолжает увеличиваться с увеличением испарения, тогда как концентрация Na+ уменьшается с тех пор как отношение Cl-/Na+ в исходной воде больше 1 (сравни с рис. 8.4). К тому же показанна на рисунке линия смешивания для вод, в которых галит растворорен, которая очень близка к линии испарения. Однако рассолы имеют гораздо более высокие отношения Ca2+/Cl-, чем ожидаются для испарения морской воды, которая показывает, что имеет место обширное взаимодействие вода-порода. Так как эти процессы могли изменить отношение Na+/Cl- также хорошо, осторожность оправданадля слишком простого объяснения, основанного только на испарении (Collins, 1975). Существуют гидрологические аргументы, которые выступают против простого испарения как главного процесса, объясняющего содержание солей в глубоких подземных водах. Рассолы испарения являются признаком фильтрации воды к поверхности (разгрузка вверх). При таких гидрологических условиях нет вод левее которых могли быть опробованы затем как реликтовые, и только осажденные соли являются свидетелями аридных условий. Подземные рассолы с концентрацией выше, чем в морской воде, вероятно получили свои высокие концентрации от растворения минералов или солей.
О значении испарения для глубоких соленых вод можно судить по изотопному составу молекул воды. Большинство рассолов в глубоких слоях имеет изотопный состав, который указывает на местные атмосферный источник (Clayton et al., 1966; Kharaka and Carothers, 1986). Рисунок 11 показывает график 2H (= D) против O в рассолах из осадочных бассейнов Америки. Оба изотопа молекул этих вод выражены по отношению к морской воде, которая поэтому имеет 2H и O == 0. Данные рассолов из каждого бассейна попадает на линию, которая может быть экстраподлирована в сторону линии метеорных вод, подсказывая единый общий источник вод из местных осадков. Смещение изотопов кислорода рассматривается как результат изотопного обмена между кислородом в воде и в породе. Водород не является компонентом породы образующим минералы (за исключением гидроксильных групп глинистых минералов и гидроокисей), и 2H показывает не обменили, по крайней мере, не такой явный сдвиг как кислород. Пробы Галф Кост ближе всего к составу возможному для реликтовой морских вод, без большого испарения.
| Рисунок 0‑21. Концентрации натрия относительно хлора для некоторых пластовых вод Третичных (T), Меловых (C), и Юрских (J) осадков, в сравнении с испарением морской водой (modified from Collins, 1975). | 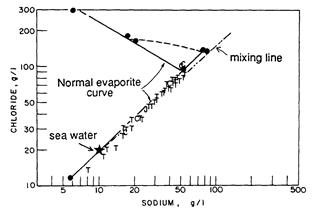
|
Хлориды в этих рассолах должны поэтому поступать от растворения солей. В осадочных бассейнах обильные количества солей доступны для растворения и увеличения растворенных концентраций. Однако, рассолы в изверженных породах Канадского щита имеют подобный состав, а источник для Cl- здесь не так доступен (Frape и Fritz, 1987). Глубокие соленые воды показывают здесь увеличение Ca2+, которое параллельно увеличению Cl-, как показано на рисунке 12. Увеличение концентраций Ca2+ является настоящим показателем взаимодействия воды-породы, для которого могут быть предложены разные объяснения. Доломитизация кальцита может быть возможностью, и подсказывается относительными потерями Mg2+ в рассолах (Collins, 1975). Растворение гипса или ангидрита и сопутствующее восстановление SO2- также может дать подъем до высоких концентраций Ca2+ (De Boer, персональное сообщение). Другое объяснение подсказывает просеивание солей (также называемое мембранной фильтрацией, или сверхфильтрацией, в главе 5) как наиболее вероятную причину относительно высокой концентрации Ca2+ (Kharaka и Berry, 1973; Graf, 1982). Рост в глубоких рассолах Канадского щита приписывается анортитовым реакциям (Frape и Fritz, 1987). (Анартит является кальциевым полевым шпатом, он может превращаться в каолинит при освобождении Ca2+ в раствор, или в альбит, Натриевый полевой шпат, пока поглощает Na+).

| Рисунок 0‑22. Изотопные составы рассолов в осадочных бассейнах Северной Америки. Линия «метеорных вод» служит местоположением величин метеорных вод всего мира (из Clayton et al., 1966. Copyright by the American Geophysical Union). |
Важно, что высокая концентрация катиона препятствует присутствию аниона, с которым он образует соль, мешает присутствию высоких концентраций CO32- в рассолах с высоким Ca2+. Это, в свою очередь, показывает низкое давление CO2, которая может также быть главной переменной. Многие гидротермальные системы в Новой Зеландии, Кении и Европе дегазируют CO2 и в этом случае концентрации Ca2+ низкие. Высокое давление CO2 в гидротермальных районах часто имеет отношение к кальцинированию карбонатных пород при температурах выше 500°C. Так как карбонатные породы повсеместны на земле, могло быть, что температура определяла относительное изобилие Ca2+ в пластовых водах. Высокие концентрации Ca2+ наблюдаемые в соленых водах, как показано на рисунке 12, ограничены площадями (осадочные бассейны, кратоны) с низкими температурами на всем протяжении.
Наконец, отметим, что относительно низкие концентрации Mg2+ в рассолах, рассмотренные ранее как признак доломитизации, могут также быть результатом формирования Mg-силикатов. Это является реакцией на более обильных количеств H4SiO40, полученной из кварца, так как этот минерал становится более растворимым, когда температура увеличивается. Это еще пример обратной зависимости между растворенными веществами и обстановкой, которая регулирует состав воды.
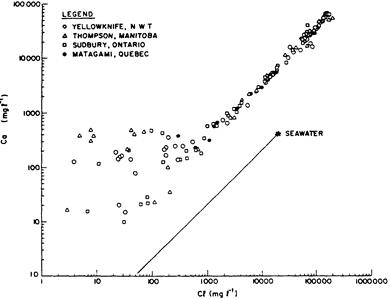
| Рисунок 0‑23. Концентрации Ca/Cl в подземных рассолах Канадского щита (Reprinted with permission from Frape and Fritz, 1987. Copyright Geological Association of Canada). |
Свойства и состав
Минерализация 300-600 г/л и более
K до 40 г/л
Br до 10 г/л
Sr до 8 г/л
H2S до 2 г/л
NH4 + N2
pH 4-5
Гипотезы их происхождения:
1. атмогенные
2. седиментогенные (талассогенные)
3. седиментогенно - инфильтрогенные
4. магматогенные
Атмогенное
Дата добавления: 2015-05-16; просмотров: 1147;
