ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Разрушение металлов и сплавов в результате протекания на их поверхности электрохимических реакций называется электрохимической коррозией.
Электрохимическая коррозия развивается при контакте металлов с раствором электролита. При электрохимической коррозии на металле протекают одновременно два процесса: окисление металла — анодный процесс:М0 – ne = Мn+. И восстановление окислителя, например кислорода или катионов водорода — катодный процесс:
О2 + 2Н2О + 4е= 4ОН- (кислородная коррозия)
2Н3О+ +2е = Н2 + 2Н2О (водородная коррозия)
Кислородная коррозия протекает в нейтральных и основных растворах, а водородная коррозия — в кислых растворах (при рН £ 4).
Электролитом может служить пленка воды, которая появляется вследствие конденсации влаги на поверхности любого металла. Скорость электрохимической коррозии зависит от электропроводности раствора электролита. Чистая вода — плохой проводник электричества, атмосферная вода проводит электрический ток значительно лучше в основном из-за химического растворения в ней диоксида углерода и образования электролита — угольной кислоты Н2СОз. Кроме того, электропроводность атмосферной воды увеличивают промышленные газовые выбросы SО2 (образуется в основном из серосодержащих примёсей угля при его сжигании), вызывающие высокую кислотность атмосферной воды:
SO2*Н2O + Н2O Û НS03- + Н3O+; рН<7
Коррозионная опасность промышленных отходящих газов велика.
Особенно коррозионно опасным может быть место контакта двух разнородных металлов. Электрохимическая коррозия, развиваемая при контакте двух металлов, имеющих разные потенциалы в данном электролите, называется контактной.Коррозия металла с более отрицательным потенциалом обычно усиливается, а коррозия металла с более положительным потенциалом замедляется. Для протекания контактной коррозии достаточно включений примеси на поверхности металла.
Например: Процесс электрохимической коррозии в месте контакта железа и меди под действием атмосферной воды, содержащей растворенный кислород воздуха, протекает следующим образом (рис. 6).
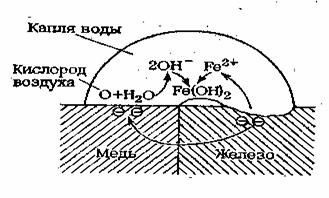
Рис. 6.Схема, поясняющая механизм контактной коррозии железа в меди в присутствии воды
Железо окисляется до катионов железа(II), которые переходят в воду: Fe0 – 2e = Fe2+.
Электроны же переходят в медь и восстанавливают кислород до гидроксил-ионов:
О2 + 2Н2О + 4е = 4ОН–.
В воде ионы Fe2+ и ОН– взаимно осаждают друг друга в виде практически нерастворимого гидроксида железа(II): Fe2+ + 2ОН– = Fe(ОН)2.
Затем атмосферный кислород окисляет часть гидроксида железа (II), а получающийся метагидроксид железа FеО(ОН) с Fе(ОН)2 при высыхании капли образуют ржавчину — бурый рыхлый порошок:
4Fе(ОН)2 + O2 = 4FеО(ОН) + 2Н2O; Fе(ОН)2 + 2FеО(ОН) = (FеII РеIII)O4 + 2Н2О
Существуют различные способы защиты от коррозий, основанные на снижении агрессивности коррозионной среды, нанесении защитных покрытий и применении электрохимических методов — электрохшиическдя защита(рис. 7).
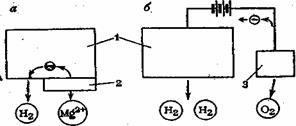
Рис. 7.Катодная защита от коррозии с помощью наложенного внешнего тока (а) и анода-протектора (б): 1 —катод защищаемый металл (железо); 2 —анод протектор (магний);
Дата добавления: 2015-05-13; просмотров: 2356;
