ЭЛЕКТРОЛИЗ. ПРИВЦИПИАЛЬНЫЕ РАЗЛИЧИЯ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ЭЛЕКТРОЛИЗЕРА
При прохождении электрического тока через металлы (проводники 1-го рода) они остаются неизменными, тогда как при прохождении электрического тока через расплавы или растворы электролитов (проводники 2-го рода) на электродах протекают процессы превращения одних веществ в другие.
При прохождении постоянного тока через расплав электролита катионы перемещаются к отрицательному электроду (катоду) и разряжаются на нем, анионы перемещаются к положительному электроду (аноду) и разряжаются на электроде.
В результате электролит разлагается (возможно и разрушение анода). Такой процесс называется электролизом. Электролиз есть разложение химического соединения под действием электрического тока, сопровождающееся разрядом ионов.
При электролизе следует различать два параллельных полупроцесса: на катоде происходит прием электронов ионами, т.е. их восстановление, на аноде происходит отдача электронов ионами, т.е. их окисление.
Например: В расплаве хлорида натрия при прохождении через него постоянного тока протекают следующие процессы. На катоде разряжаются ноны Na+, а на аноде разряжаются ионы С1-: NaCl = Na+ + Cl-
на катоде Na + e = Na0 (восстановление)
на аноде С1- - е = С1° (окисление)
2С1° = С12 (образование молекул)
Общее уравнение процесса, протекающего в расплаве NаС1 под действием электрического тока: 2NаС1 – электролиз ® 2Na + Cl2.
Электролиз — это окислительно-восстановительный процесс, при котором полупроцессы окисления и восстановления отделены друг от друга в пространстве. Полупроцессы при электролизе называются: анодным окислением и катодным восстановлением.
Принципиальное различие в действии гальванического элемента и электролизной ячейки (электролизера) заключается в том, что процессы, протекающие в них, имеют противоположные направления (рис. 4).
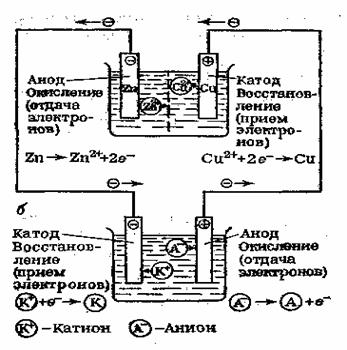
Рис. 4. Сравнительная схема, иллюстрирующая принцип действия гальванического элемента (вверху) и электролизера (внизу).
Гальванический элемент — это источник электрического тока, а электролизер — потребитель электрического тока.
В гальваническом элементе химическая энергия превращается в электрическую, образующиеся вещества менее энергоемки, чем исходные. В электролизере, наоборот, электрическая энергия превращается в химическую, образующиеся вещества более энергоемки, чем исходные.
В замкнутой гальванической цепи электрохимические процессы окисления и восстановления протекают самопроизвольно.В электролизере электрохимические процессы окисления и восстановления идут только под внешним воздействиемэлектрического тока, т.е. самопроизвольно эти процессы не протекают.
Следует обратить внимание на то, что
Дата добавления: 2015-05-13; просмотров: 1984;
