ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Если два различных металла погрузить в раствор электролита, то между ними возникает электрическое напряжение (разность потенциалов).Такая система
Металл 1 | Раствор электролита | Металл 2
называется гальваническим элементом,или гальванической цепью.Вместо металлов в гальванической цепи можно использовать и другие вещества с металлической проводимостью, например графит.
Возникновение разности потенциалов между обоими металлическими электродами объясняется различной склонностью металлов отдавать катионы в раствор электролита. У поверхности каждого из электродов возникает двойной электрический слой (см. рис. 1), который оказывает противодействие дальнейшему переходу катионов в раствор. Если оба металла соединить металлическим проводником,то вследствие электропроводности раствора электролита (ионной проводимости) получается замкнутая электрическая цепь (рис. 2).
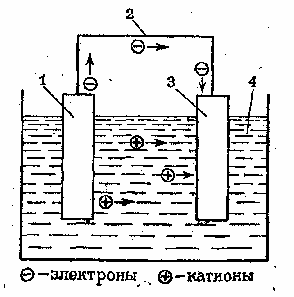
Рис. 2. Принципиальная схема гальванического элемента. 1 – неблагородный металл; 2 – проводник; благородный металл; раствор электролита.
В этой цепи поток электронов будет перемещаться от менее благородного металла через внешний участок цепи (металлический проводник) к более благородному металлу. При этом в растворе электролита катионы будут двигаться к благородному металлу и разряжаться под действием имеющихся на нем электронов. В результате в замкнутой гальванической цепи возникнет электрический ток.
Электрохимические процессы, лежащие в основе действия гальванических элементов, схематически можно представить так:
| Неблагородный металл | Благородный металл |
| Окисление | Восстановление |
| Отдача ее, образование катионов. | Прием ее, разрядка катионов |
Например: Гальванический элемент Даниэля — Якоби (рис. 3) состоит из цинкового электрода — цинковая пластина, погруженная в раствор сульфата цинка(II), и медного электрода — медная пластина, погруженная в раствор сульфата меди(II): Zn | ZnSO4 || СuSО4 | Сu.
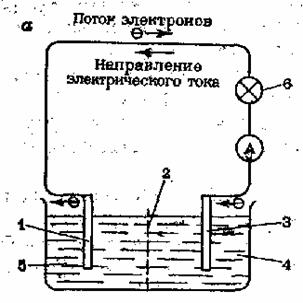
Рис. 3. Гальванический элемент Даниэля – Якоби. 1 – цинковая пластина; 2 – диафрагма; 3 – медная пластина; 4 – раствор CuSO4; 5 – раствор ZnSO4; 6 – лампа накаливания.
Таким образом, данный элемент представляет собой электрохимическую систему:
| Металл 1 | Раствор электролита 1 | Раствор электролита 2 | Металл 2 |
При замыкании цепи в этом элементе протекают следующие электродные процессы:
Zn0 -2е- = Zn2+ – (окисление); Сu2+ + 2е-— Сu0 – (восстановление) или суммарно (окислительно-восстановительная реакция): Zn0 + Сu2+ = Zn2+ + Сu0.
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов, а другой их принимает. При этом на одном электроде возникает избыток электронов (в данном примере — на цинке), а на другом — недостаток электронов (на меди). Электрод с избытком электронов называют отрицательным полюсомгальванического элемента, или анодом,а электрод с недостатком электронов — положительным полюсом, или катодом(в элементе Даниэля — Якоби это соответственно цинковый и медный электроды).
Дата добавления: 2015-05-13; просмотров: 1450;
