СУЩНОСТЬ, ЦЕЛИ И ЗАДАЧИ МАРКЕТИНГА 3 страница
ческие модификации ферментов, осуществляемые через ОН-группы серина,
реже – тирозина или за счет нековалентных взаимодействий с молекулой
фермента.
27.Аллостерическая регуляция. Во многих строго биосинтетических реак-
циях основным типом регуляции скорости многоступенчатого фермента-
тивного процесса является ингибирование по принципу обратной
связи. Это означает, что конечный продукт биосинтетической цепи подав-
ляет активность фермента, катализирующего первую стадию синтеза,
которая является ключевой для данной цепи реакции. Поскольку конечный
продукт структурно отличается от субстрата, он связывается с аллостери-
ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-
рование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый био-
синтетический процесс, каждая стадия которого катализируется собст-
венным ферментом:
Скорость подобной суммарной последовательности реакций в значи-
тельной степени определяется концентрацией конечного продукта Р,
накопление которого выше допустимого уровня оказывает мощное инги-
бирующее действие на первую стадию процесса и соответственно на
фермент E1.
Впервые существование подобного механизма контроля активности
ферментов метаболитами было обнаружено у Е.coli при исследовании
синтеза изолейцина и ЦТФ. Оказалось, что изолейцин, являющийся
конечным продуктом синтеза, избирательно подавляет активность треонин-
дегидратазы, катализирующей первую стадию последовательного процесса
превращения треонина в изолейцин, насчитывающего пять ферментативных
реакций:
Аналогично ЦТФ как конечный продукт биосинтетического пути оказы-
вает ингибирующий эффект на первый фермент (аспартаткарбамоилтран-
сферазу), регулируя тем самым свой собственный синтез (см. главу 13).
Этот тип ингибирования получил название ингибирования по принципу
обратной связи, или ретроингибирования. Существование его доказано
во всех живых организмах. В настоящее время он рассматривается как один
из ведущих типов регуляции активности ферментов и клеточного мета-
болизма в целом *.
С другой стороны, в амфиболических процессах, выполняющих одно-
временно биосинтетические и биодеградативные функции **, доказано существование регуляции как по типу ретроингибирования, так и макроэрги-
ческими соединениями – индикаторами энергетического состояния клетки.
Для амфиболических процессов уникальным типом регуляции, свойствен-
ным только им, является, кроме того, активация предшественником,
когда первый метаболит в многоступенчатом пути активирует фермент,
катализирующий последнюю стадию. Так, доказано активирующее влияние
глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент
гликогенсинтазу.
Подобные типы ингибирования конечным продуктом и активирования
первым продуктом свойственны аллостерическим (регуляторным) фермен-
там, когда эффектор, модулятор, структурно отличаясь от субстрата,
связывается в особом (аллостерическом) центре молекулы фермента, прост-
ранственно удаленном от активного центра. Следует, однако, иметь в виду,
что модуляторами аллостерических ферментов могут быть как активаторы,
так и ингибиторы. Часто оказывается, что сам субстрат оказывает активи-
рующий эффект. Ферменты, для которых и субстрат, и модулятор пред-
ставлены идентичными структурами, носят название гомотропных в от-
личие от гетеротропных ферментов, для которых модулятор имеет
отличную от субстрата структуру. Взаимопревращение активного и неак-
тивного аллостерических ферментов в упрощенной форме, а также конфор-
мационные изменения, наблюдаемые при присоединении субстрата и эф-
фекторов, представлены на рис. 4.25. Присоединение отрицательного эф-
фектора к аллостерическому центру вызывает значительные изменения
конфигурации активного центра молекулы фермента, в результате чего
фермент теряет сродство к своему субстрату (образование неактивного
комплекса).
Аллостерические взаимодействия проявляются в характере кривых за-
висимости начальной скорости реакции от концентрации субстрата или
эффектора, в частности в S-образности этих кривых (отклонение от гипер-
болической кривой Михаэлиса-Ментен). S-образный характер зависимости
v от [S] в присутствии модулятора обусловлен эффектом кооперативности.
Это означает, что связывание одной молекулы субстрата облегчает связы-
вание второй молекулы в активном центре, способствуя тем самым увели-
чению скорости реакции. Кроме того, для аллостерических регуляторных
ферментов характерна нелинейная зависимость скорости реакции от кон-
центрации субстрата.
28. Четвертичная структура аллостерических ферментов. Кооперативные изменения конформации протомеров при функционировании.
29. Фосфорилирование дефосфорилирование.
Протеинкиназы катализируют фосфорилирование белков по гидроксильным группам серина, треонина и тирозина. Если фосфорилируемые белки это тоже ферменты, то их активность в результате фосфорилирования в одних случаях уменьшается, в других — увеличивается. Например, в клетках жировой ткани есть липаза, существующая в двух формах — фосфопротеина и простого белка.
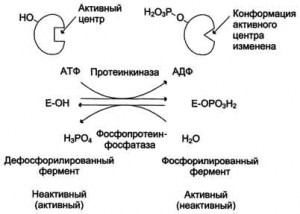
Регуляция ферментов.
Эти формы могут превращаться друг в друга. Фосфопротеин образуется в результате действия протеинкиназы и может вновь превращаться в простой белок при действии фосфопротеинфосфатазы — фермента, гидролитически отщепляющего фосфорную кислоту от фосфопротеинов Фосфорилированная липаза обладает значительно более высокой активностью, чем нефосфорилированная.
Протеинкиназы — это группа ферментов, различающихся специфичностью: разные протеинкиназы фосфорилируют разные белки. То же можно сказать и о проте-инфосфатазах. Такой механизм регулирует активность очень многих ферментов.Одним из важных примеров такой регуляции является регуляция протеинкиназы А. Протеинкиназа А в активной форме представляет собой белок, построенный из одной пептидной цепи (субъединица С, каталитическая). В клетке имеется другой белок (субъединица R, регуляторная), способный соединяться с белком С, причем образуется тетрамерный комплекс R2C2. Этот комплекс не обладает ферментативной активностью: субъединица R выступает в роли белка-модулятора — ингибирует фермент (субъединицу С). Активация фермента происходит при участии цик-лоаденозинмонофосфата (З'^'-цикло-АМФ, или цАМФ).На поверхности субъединицы R есть два центра связывания цАМФ; после присоединения цАМФ изменяется конформация белка, при этом сродство субъединиц R к субъединицам С уменьшается, и происходит диссоциация комплекса с образованием двух молекул активной протеинкиназы А (рис. 2.29). Этот процесс обратимый, его направление зависит от концентрации цАМФ в клетке: повышение концентрации ведет к активации протеинкиназы,
30. Участие ферментов в проведении гормонального сигнала в клетку (лекция).
31. Изоферменты, или изоэнзимы,– это множественные формы фермента, ка-
тализирующие одну и ту же реакцию, но отличающиеся друг от друга по
физическим и химическим свойствам, в частности по сродству к субстрату,
максимальной скорости катализируемой реакции (активности), электро-
форетической подвижности или регуляторным свойствам.
В живой природе имеются ферменты, молекулы которых состоят из двух
и более субъединиц, обладающих одинаковой или разной первичной,
вторичной или третичной структурой. Субъединицы нередко называют
протомерами, а объединенную олигомерную молекулу – мультимером
Считают, что процесс олигомеризации придает субъединицам белков
повышенную стабильность и устойчивость по отношению к действию
денатурирующих агентов, включая нагревание, влияние протеиназ и др.
Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос
о существенности четвертичной структуры для каталитической активности
ферментов, поскольку пока отсутствуют методы, позволяющие в «мягких»
условиях разрушить только лишь четвертичную структуру. Применяемые
обычно методы жесткой обработки (экстремальные значения рН, высокие
концентрации гуанидинхлорида или мочевины) приводят к разрушению не
только четвертичной структуры, но и вторичной и третичной структур
стабильного олигомерного фермента, протомеры которого оказываются
денатурированными и, как следствие этого, лишенными биологической
активности.
Следует указать на отсутствие ковалентных, главновалентных связей
между субъединицами. Связи в основном являются нековалентными,
поэтому такие ферменты довольно легко диссоциируют на протомеры.
Удивительной особенностью таких ферментов является зависимость актив-
ности всего комплекса от способа упаковки между собой отдельных
субъединиц. Если генетически различимые субъединицы могут сущест-
вовать более чем в одной форме, то соответственно и фермент, образо-
ванный из двух или нескольких типов субъединиц, сочетающихся в разных
количественных пропорциях, может существовать в нескольких сходных, но
не одинаковых формах. Подобные разновидности фермента получили
название изоферментов (изоэнзимов или, реже, изозимов). В частности,
если фермент состоит из 4 субъединиц двух разных типов – Н и М (сер-
дечный и мышечный), то активный фермент может представлять собой
одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ,
ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам
ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов
осуществляется различными генами и в разных органах экспрессируется
по-разному.
В одних случаях субъединицы имеют почти идентичную структуру
и каждая содержит каталитически активный участок (например, β-галакто-
зидаза, состоящая из 4 субъединиц). В других случаях субъединицы ока-
зываются неидентичными. Примером последних может служить трипто-
фансинтаза, состоящая из 2 субъединиц, каждая из которых наделена
собственной (но не основной) энзиматической активностью, однако, только
будучи объединенными в макромолекулярную структуру, обе субъединицы
проявляют триптофансинтазную активность.
Термин «множественные формы фермента» применим к белкам, ка-
тализирующим одну и ту же реакцию и встречающимся в природе в орга-
низмах одного вида. Термин «изофермент» применим только к тем мно-
жественным формам ферментов, которые появляются вследствие гене-
тически обусловленных различий в первичной структуре белка (но не
к формам, образовавшимся в результате модификации одной первичной
последовательности).
Одним из наиболее изученных 4 ферментов, множественность форм
которого детально изучена методом гель-электрофореза, является ЛДГ,
катализирующая обратимое превращение пировиноградной кислоты в мо-
лочную. Пять изоферментов ЛДГ образуются из 4 субъединиц примерно
одинакового размера, но двух разных типов. Поскольку Н-протомеры несут
более выраженный отрицательный заряд при рН 7,0–9,0, чем М-про-
томеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электро-
форезе будет мигрировать с наибольшей скоростью в электрическом поле
к положительному электроду (аноду). С наименьшей скоростью будет
продвигаться к аноду изофермент М4, в то время как остальные изо-
ферменты будут занимать промежуточные позиции. Следует подчеркнуть,
что изоферменты ЛДГ, обладая почти одинаковой ферментативной актив-
ностью, различаются некоторыми физико-химическими свойствами: мо-
лекулярной массой, электрофоретической подвижностью, отношением к ак-тиваторам и ингибиторам и др., однако для каждой ткани в норме
характерно свое соотношение форм (изоферментный спектр) ЛДГ. Напри-
мер, в сердечной мышце преобладает Н4, т.е. ЛДГ1 , а в скелетных мышцах
и печени – М4 (ЛДГ5) (рис. 4.6). Эти обстоятельства широко используют
в клинической практике, поскольку изучение появления изоферментов ЛДГ
(и ряда других ферментов) в сыворотке крови может представлять интерес
для дифференциальной диагностики органических и функциональных по-
ражений органов и тканей. По изменению содержания изоферментов
в сыворотке крови можно судить как о топографии патологического
процесса, так и о степени поражения органа или ткани.
32. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ

Современные классификация и номенклатура ферментов были разработаны
Комиссией по ферментам Международного биохимического союза и ут-
верждены на V Международном биохимическом конгрессе в 1961 г.
в Москве *.
Необходимость систематики номенклатуры диктовалась прежде всего
стремительным ростом числа вновь открываемых ферментов, которым
разные исследователи присваивали названия по своему усмотрению. Более
того, одному и тому же ферменту часто давали два или несколько названий,
что вносило путаницу в номенклатуру. Некоторые названия ферментов
вообще не отражали тип катализируемой реакции, а при наименовании
фермента исходили из названия субстрата, на который действует фермент,
с добавлением окончания -аза: в частности, амилазы (ферменты, гидро-
лизирующие углеводы), липазы (действующие на липиды), протеиназы
(гидролизирующие белки) и т.д.
До 1961 г. не было и единой классификации ферментов. Трудности
заключались в том, что разные исследователи за основу классификации
ферментов брали различные принципы. Комиссией были рассмотрены
3 принципа, которые могли служить основой для классификации ферментов
и их обозначения. Первый принцип – химическая природа фермента, т.е.
принадлежность к флавопротеинам, пиридоксальфосфатпротеинам, гемо-
протеинам, металлопротеинам и т. д. Однако этот принцип не мог служить
общей основой для классификации, так как только для небольшого числа
ферментов известны простетические группы, доступные идентификации
и прямому определению. Второй принцип – химическая природа субстрата,
на который действует фермент. По этому принципу трудно классифи-
цировать фермент, так как в качестве субстрата могут служить разнообраз-
ные соединения внутри определенного класса веществ (белки, углеводы,
липиды, нуклеиновые кислоты) и бесчисленное множество промежуточных
продуктов обмена. В основу принятой классификации положен третий
принцип – тип катализируемой реакции, который является специфич-
ным для действия любого фермента. Этот принцип логично использовать
в качестве основы для классификации и номенклатуры ферментов.
Таким образом, тип катализируемой химической реакции в сочетании
с названием субстрата (субстратов) служит основой для систематического
наименования ферментов. Согласно Международной классификации, фер-
менты делят на шесть главных классов, в каждом из которых несколько
подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы;
5) изомеразы; 6) лигазы (синтетазы) (табл. 4.5).
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, ката-
лизирующие с участием двух субстратов окислительно-восстановительные
реакции, лежащие в основе биологического окисления. Систематические
названия их составляют по форме «донор: акцептор оксидоредуктаза».
Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы
(ЛДГ).
Различают следующие основные оксидоредуктазы: аэробные дегидро-
геназы или оксидазы, катализирующие перенос протонов (электронов)
непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие
перенос протонов (электронов) на промежуточный субстрат, но не на
кислород; цитохромы, катализирующие перенос только электронов. К это-
му классу относят также гемсодержащие ферменты каталазу и пероксидазу,
катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие
реакции межмолекулярного переноса различных атомов, групп атомов
и радикалов. Наименование их составляется по форме «донор: транспор-
тируемая группа – трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных ос-
татков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных
остатков, азотистых групп, остатков фосфорной и серной кислот и др.
Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-
трансферазы, фосфотрансферазы и др.
Гидролазы. В класс гидролаз входит большая группа ферментов, ката-
лизирующих расщепление внутримолекулярных связей органических ве-
ществ при участии молекулы воды. Наименование их составляют по форме
«субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализи-
рующие реакции гидролиза и синтеза сложных эфиров; гликозидазы,
ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы,
катализирующие гидролиз фосфоангидридных и пептидных связей; ами-
дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей
С—О, С—С, С—N и других, а также обратимые реакции отщепления
различных групп от субстратов не гидролитическим путем. Эти реакции
сопровождаются образованием двойной связи или присоединением групп
к месту разрыва двойной связи. Ферменты обозначают термином «суб-
страт-лиазы». Например, фумарат-гидратаза (систематическое название
«L-малат-гидролаза») катализирует обратимое отщепление молекулы
воды от яблочной кислоты с образованием фумаровой кислоты. В эту же
группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
Изомеразы. К классу изомераз относят ферменты, катализирующие
взаимопревращения оптических и геометрических изомеров. Системати-
ческое название их составляют с учетом типа реакции: «субстрат – цис-
транс-изомераза». Если изомеризация включает внутримолекулярный пе-
ренос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на
амино- и оксикислоты, углеводы и их производные; внутримолекулярные
оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз;
внутримолекулярные трансферазы, переносящие ацильные, фосфорильные
и другие группы, и т.д.
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие
синтез органических веществ из двух исходных молекул с использованием
энергии распада АТФ (или другого нуклеозидтрифосфата). Системати-
ческое название их составляют по форме «X : Y лигаза», где X и Y обозна-
чают исходные вещества. В качестве примера можно назвать L-глутамат:
аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-
за»), при участии которой из глутаминовой кислоты и аммиака в при-
сутствии АТФ синтезируется глутамин.
СПИСОК ФЕРМЕНТОВ
На основании разработанной системы, которая служит основой как для
классификации, так и для нумерации (индексации) ферментов, Между-
народная комиссия подготовила также Классификацию ферментов (КФ)
с включением списка ферментов, первоначально состоявшего к 1961 г.
примерно из 900 ферментов. В списке ферментов (см. Номенклатуру
ферментов, 1978) насчитывалось уже 2142 индивидуальных фермента, к де-
кабрю 1995 г. их идентифицировано более 3500. В списке для каждого
фермента, помимо кодового номера (шифра), приводятся систематическое
(рациональное) название, рекомендуемое (рабочее) название, химическая
реакция, которую катализирует данный фермент, а также примечания
о специфичности действия. Номер каждому ферменту рекомендуется при-
сваивать по четырехзначному коду.
Таким образом, код каждого фермента содержит четыре цифры,
разделенные точками, и составляется по определенному принципу. Первая
цифра указывает номер одного из шести главных классов ферментов.
Вторая цифра означает подкласс, характеризующий основные виды суб-
стратов, участвующих в данном типе химических превращений. Например,
у трансфераз вторая цифра указывает на природу той группы, которая
подвергается переносу, у гидролаз – на тип гидролизуемой связи и т.д. Эти
подклассы в свою очередь делятся на более частные подгруппы (подпод-
классы), отличающиеся природой химических соединений доноров или
акцепторов, участвующих в данной подгруппе реакций. Номер (цифра)
подподкласса ставят на 3-е место в шифре фермента. У гидролаз, например,
эта цифра уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой
группы и т.д. Первые 3 цифры кода точно определяют тип фермента.
Наконец, все ферменты, относящиеся к данному подподклассу, получают
порядковый номер в алфавитном порядке, который ставят на 4-е место
в шифре.
Каждый фермент, характеризующийся постоянной совокупностью 4
цифр, имеет соответствующий код, под которым он внесен в список
ферментов. В качестве примера в табл. 4.6 приведены 2 фермента из списка.
Следует особо отметить, что Международную классификацию фермен-
тов нельзя считать абсолютно совершенной, поскольку она в некоторых
отношениях не соответствует общепринятой в органической химии клас-
сификации химических реакций, несмотря на то что ферменты катали-
зируют по существу те же реакции.
34. Вопрос о локализации ферментов в структурных образованиях клетки
(ядро, митохондрии, лизосомы и др.) является чрезвычайно важным,
особенно в препаративной энзимологии, когда перед исследователем
поставлена задача изолировать и выделить фермент в чистом виде.
Сравнительно легко обнаружить локализацию фермента методами цито-
и гистохимии. Для этого тонкие срезы органа инкубируют с соответст-
вующими субстратами и после инкубации локализацию продукта реакции
устанавливают добавлением подходящих реактивов до появления специ-
фической окраски.
В препаративной энзимологии чаще пользуются методом дифферен-
циального центрифугирования гомогенатов тканей (рис. 4.26). Для этого
сначала разрушают клеточную структуру с помощью подходящего де-
зинтегратора и полученную квазиоднородную (гомогенизированную) массу
подвергают дифференциальному центрифугированию при температуре
0–4°С. Обычно распределение ферментов изучают в последовательных
индивидуальных фракциях, изолированных при дробном центрифугирова-
нии гомогенатов, в частности во фракции ядер, которую получают при
низкой скорости центрифугирования, во фракции митохондрий, которая
осаждается при средней скорости центрифугирования, во фракции микро-
сом (или рибосом), для изолирования которой требуется высокая скорость
центрифугирования, и, наконец, в оставшейся прозрачной надосадочной
жидкости (супернатант), представляющей собой растворимую фракцию
цитоплазмы. Следует отметить, что фракция митохондрий не является
гомогенной, поскольку из нее удается изолировать частицы, известные как
лизосомы, размер которых занимает промежуточное место между разме-
рами митохондрий и микросом. В свою очередь микросомальная фракция
также является гетерогенной, поскольку состоит в основном из элементов
эндоплазматической сети неоднородного строения.
При помощи метода фракционирования гомогенатов органов и тканей
в центрифугах было показано, что ядерная фракция печени и почек
содержит незначительное число ферментов, хотя известно, что в ядрах
осуществляется синтез некоторых белков. Основное место синтеза белка,
как теперь установлено,– фракция рибосом цитоплазмы. Показано, кроме
того, что ферменты гликолиза сосредоточены преимущественно в раство-
римой фракции цитоплазмы, в то время как цитохромоксидаза и ферменты
цикла Кребса локализованы во фракции митохондрий. С митохондриями
связаны также ферменты, катализирующие окислительное фосфорилиро-
вание и распад жирных кислот. Ферменты, катализирующие биосинтез
жирных кислот, наоборот, содержатся в растворимой фракции цитоплазмы.
Для изолирования и выделения ферментов из биологических объектов
в чистом (гомогенном) состоянии используют весь арсенал методов выде-
ления белков в индивидуальном виде (см. главу 1).
35/36/37
Достижения энзимологии находят все большее применение в медицине,
в частности в профилактике, диагностике и лечении болезней. Успешно
развивается новое направление энзимологии – медицинская энзимология,
которая имеет свои цели и задачи, специфические методологические под-
ходы и методы исследования. Медицинская энзимология развивается по
трем главным направлениям, хотя возможности применения научных дос-
тижений энзимологии в медицине теоретически безграничны, в частности
в области энзимопатологии, энзимодиагностики и энзимотерапии.
Область исследований энзимопатологии является теоретической,
фундаментальной частью патологии. Она призвана изучать молекулярные
основы развития патологического процесса, основанные на данных нару-
шения механизмов регуляции активности или синтеза индивидуального
фермента или группы ферментов. Обладая высокой каталитической актив-
ностью и выраженной органотропностью, ферменты могут быть исполь-
зованы в качестве самых тонких и избирательных инструментов для
направленного воздействия на патологический процесс. Как известно, из
более чем 5000 наследственных болезней человека молекулярный механизм
развития выяснен только у 2-3 десятков. Считают, что развитие болезни
чаще всего связано с наследственной недостаточностью или полным от-
сутствием синтеза одного-единственного фермента в организме больного.
Иногда болезни называют также энзимопатиями. Так, галактоземия – на-
следственное заболевание, при котором наблюдается ненормально высокая
концентрация галактозы в крови. Болезнь развивается в результате наслед-
ственного дефекта синтеза фермента гексозо-1-фосфат-уридилтрансферазы,
катализирующего превращение галактозы в легкометаболизируемую глю-
козу. Причиной другого наследственного заболевания – фенилкетонурии,
сопровождающейся расстройством психической деятельности, является по-
теря клетками печени способности синтезировать фермент, катализирую-
щий превращение фенилаланина в тирозин (см. главу 12).
Энзимопатология успешно решает и проблемы патогенеза соматических
болезней. Созданы крупные научные центры и научно-исследовательские
институты, в которых ведутся работы по выяснению молекулярных основ
атеросклероза, злокачественного роста, ревматоидных артритов и др.
Нетрудно представить огромную роль ферментных систем или даже от-
дельных ферментов, нарушение регуляции активности и синтеза которых
приводит к формированию или развитию патологического процесса.
Второе направление медицинской энзимологии – энзимодиагнос-
тика – развивается по двум путям. Один путь – использование ферментов
в качестве избирательных реагентов для открытия и количественного
определения нормальных или аномальных химических веществ в сыворотке
крови, моче, желудочном соке и др. (например, выявление при помощи
ферментов глюкозы, белка или других веществ в моче, в норме не обна-
руживаемых). Другой путь – открытие и количественное определение самих
ферментов в биологических жидкостях при патологии. Оказалось, что ряд
ферментов появляется в сыворотке крови при распаде клеток (отсюда их
название «некротические ферменты»). Для диагностики органических и
функциональных поражений органов и тканей широко применяются от-
дельные ферментные тесты, выгодно отличающиеся от других химических
диагностических тестов, используемых в клинике, высокой чувствитель-
ностью и специфичностью. Известно около 20 тестов, основанных на
количественном определении активности ферментов (и изоферментов),
главным образом в крови (реже в моче), а также в биоптатах (кусочки
тканей, полученные при биопсии). Следует отметить, что из огромного
числа ферментов (более 3500), открытых в природе (частично и в организме
человека), в диагностической энзимологии используется лишь ограничен-
Дата добавления: 2015-04-05; просмотров: 991;
