СУЩНОСТЬ, ЦЕЛИ И ЗАДАЧИ МАРКЕТИНГА 2 страница
лиза, не является коэнзимом. В то же время простетическую группу
(ковалентно связанный небелковый компонент, необходимый для опреде-
ленной функции) можно назвать коферментом, если она непосредственно
участвует в энзиматической реакции. Простетическая группа, которая не
вовлечена в акт катализа, но функционально является существенным как
для фермента, так и для некаталитического белка, может быть названа
кофактором. И наконец, кофактор и кофермент, непрочно связанные (или
слабо связанные) с ферментом или белком, тем не менее не классифи-
цируются в качестве простетических групп.
Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет пока-
зано далее, также выполняют роль кофакторов, хотя они не относятся ни
к коферментам, ни к простетическим группам. Известны примеры, когда
ионы металлов прочно связаны с белковой молекулой, выполняя функции
простетической группы. В частности, очищенный фермент, катализирую-
щий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую
кислоту, содержит 8 атомов меди на одну молекулу; все они настолько
прочно связаны с белковой молекулой, что даже не обмениваются с ионо-
обменными смолами и не отделяются методом диализа. Более того,
с помощью метода электронного парамагнитного резонанса показано
участие ионов меди в промежуточном переносе электронов. Интересно
отметить, что свободные ионы меди также наделены каталитической
активностью при окислении аскорбиновой кислоты, однако эта активность
повышается во многие тысячи раз, если ионы меди соединяются с апофер-
ментом в единый комплекс – холофермент.
Данные о важнейших коферментах и простетических группах ферментов,
включая их наименования и структуру, химическую природу витамина,
входящего в их состав, и характер выполняемой биохимической функции
в метаболизме, детально рассмотрены в главах 7 и 9–13.
Получены доказательства кофакторной функции в ферментативных
реакциях и ряда других биологически активных соединений, не относящихся
к витаминам: HS-глутатиона, АТФ, липоевой кислоты, производных ну-
клеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат),
порфиринсодержащих веществ и др. Сюда же могут быть отнесены тРНК,
которые в составе ферментов аминоацил-тРНК-синтетаз принимают ак-
тивное участие в транспорте аминокислот в рибосоме, где осуществляется
синтез белка (см. главу 14).
Следует отметить одну отличительную особенность двухкомпонентных
ферментов: ни кофактор отдельно (включая большинство коферментов), ни
сам по себе апофермент каталитической активностью не наделены, и только
их объединение в одно целое, протекающее не хаотично, а в соответствии
с программой их структурной организации, обеспечивает быстрое про-
текание химической реакции.
17.Коферменты:
По химической природе: витаминные, витаминоподобные, невитаминные.
По механизму действия: переносчики атомов водорода,электронов,протонов.
переносчики отдельных химических групп.
18.Над и НАДФ
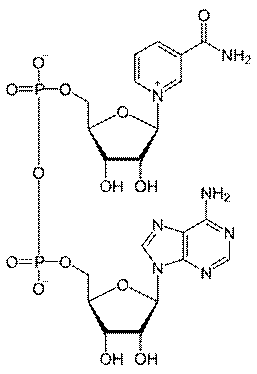
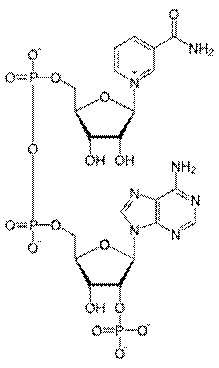
Производные PP витамина. Биохимическая функция: дыхание,перенос водорода.
Витамин РР входит в состав НАД или НАДФ,
являющихся коферментами большого числа обратимо действующих в
окислительно-восстановительных реакциях дегидрогеназ (формулы ко-
ферментов приведены в главе 9).
Показано, что ряд дегидрогеназ использует только НАД и НАДФ
(соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа),
другие могут катализировать окислительно-восстановительные реакции
в присутствии любого из них (например, глутаматдегидрогеназа; см. главу
12). В процессе биологического окисления НАД и НАДФ выполняют роль
промежуточных переносчиков электронов и протонов между окисляемым
субстратом и флавиновыми ферментами (молекулярные механизмы учас-
тия пиридиновых нуклеотидов в этом процессе подробно рассматриваются
19.ФАД и ФМН


Производные витамина B2.Биологическая функция дыхание, перенос водорода.
Рибофлавин входит в состав флавиновых кофер-
ментов, в частности ФМН и ФАД *, являющихся в свою очередь просте-
тическими группами ферментов ряда других сложных белков – флаво-
протеинов. Некоторые флавопротеины в дополнение к ФМН или ФАД
содержат еще прочно связанные неорганические ионы, в частности железо
или молибден, наделенные способностью катализировать транспорт элек-
тронов. Различают 2 типа химических реакций, катализируемых этими
ферментами. К первому относятся реакции, в которых фермент осуществ-
ляет прямое окисление с участием кислорода, т.е. дегидрирование (от-
щепление электронов и протонов) исходного субстрата или промежуточ-
ного метаболита. К ферментам этой группы относятся оксидазы L- и
D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др.
Вторая группа реакций, катализируемых флавопротеинами, характеризует-
ся переносом электронов и протонов не от исходного субстрата, а от
восстановленных пиридиновых коферментов. Ферменты этой группы иг-
рают главную роль в биологическом окислении. В каталитическом цикле
изоаллоксазиновый остаток ФАД или ФМН подвергается обратимому
восстановлению с присоединением электронов и атомов водорода к N1
и N10. ФМН и ФАД прочно связываются с белковым компонентом, иногда
даже ковалентно, как, например, в молекуле сукцинатдегидрогеназы.
ФМН синтезируется в организме животных из свободного рибофлавина
и АТФ при участии специфического фермента рибофлавинкиназы:
Образование ФАД в тканях также протекает при участии специфического
АТФ-зависимого фермента ФМН-аденилилтрансферазы. Исходным ве-
ществом для синтеза является ФМН:
20.КоА
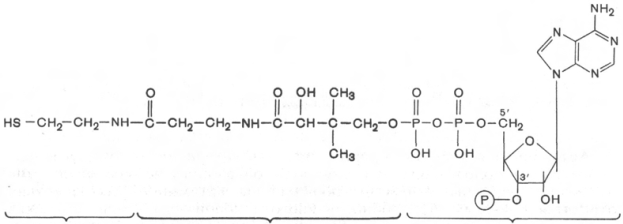
Витамин В3,транспорт ацильных групп.
Пантотеновая кислота входит в состав кофер-
мента А, или коэнзима А (КоА). Название «коэнзим А» (кофермент
ацилирования) связано с тем, что это соединение участвует в фермен-
тативных реакциях, катализирующих как активирование, так и перенос
ацетильного радикала СН3СО; позже оказалось, что КоА активирует
и переносит также другие кислотные остатки (ацилы). В результате обра-
зования ацил-КоА происходит активация карбоновой кислоты, которая
поднимается на более высокий энергетический уровень, создающий вы-
годные термодинамические предпосылки для ее использования в реакциях,
протекающих с потреблением энергии.
Строение КоА расшифровал Ф. Линен. В основе структуры лежит
остаток 3'-фосфоаденозин-5'-дифосфата (отличается от АТФ наличием у
3'-гидроксила фосфатной группы), соединенный с остатком пантотеновой
кислоты, карбонильная группа которой в свою очередь связана с остатком
β-меркаптоэтиламина (тиоэтиламина).
Реакционноспособным участком молекулы КоА в биохимических реак-
циях является SH-группа, поэтому принято сокращенное обозначение КоА
в виде SH-KoA. О важнейшем значении КоА в обмене веществ (как будет
показано далее – см. главы 9–11) свидетельствуют обязательное непосред-
ственное участие его в основных биохимических процессах, окисление
и биосинтез высших жирных кислот, окислительное декарбоксилирование
α-кетокислот (пируват, α-кетоглутарат), биосинтез нейтральных жиров,
фосфолипидов, стероидных гормонов, гема гемоглобина, ацетилхолина,
гиппуровой кислоты и др.
21.Тиаминпирофосфат
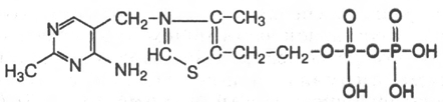
В1, декарбоксилирование а-кетокислот,перенос активного альдегида (транскетолаза).
Экспериментально доказано, что витамин B1 в
форме ТПФ является составной часть минимум 5 ферментов, участвующих
в промежуточном обмене веществ. ТПФ входит в состав двух сложных
ферментных систем – пируват- и α-кетоглутаратдегидрогеназных
комплексов, катализирующих окислительное декарбоксилирование
пировиноградной и α-кетоглутаровой кислот. В составе транскетолазы
ТПФ участвует в переносе гликоальдегидного радикала от кетосахаров на
альдосахара (см. главу 10). ТПФ является коферментом пируватдекар-
боксилазы клеток дрожжей (при алкогольной ферментации) и дегидро-
геназы γ-оксикетоглутаровой кислоты.
Приведенными примерами, вероятнее всего, не ограничиваются биоло-
гические функции тиамина. В частности, ТПФ участвует в окислительном
декарбоксилировании глиоксиловой кислоты и α-кетокислот, образующих-
ся при распаде аминокислот с разветвленной боковой цепью; в растениях
ТПФ является эссенциальным кофактором при синтезе валина и лейцина
в составе фермента ацетолактатсинтетазы.
22.Пиродаксальфосфат.
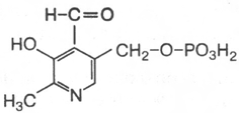
В6,обмена аминокислот,перенос аминогрупп.
Оказалось, что, хотя все три производных 3-окси-
пиридина наделены витаминными свойствами, коферментные функции
выполняют только фосфорилированные производные пиридоксаля и пи-
ридоксамина.
Фосфорилирование пиридоксаля и пиридоксамина является фермен-
тативной реакцией, протекающей при участии специфических киназ. Синтез
пиридоксальфосфата, например, катализирует пиридоксалькиназа, которая
наиболее активна в ткани мозга. Эту реакцию можно представить сле-
дующим уравнением:
Пиридоксаль + АТФ –> Пиридоксальфосфат + АДФ.
Доказано, что в животных тканях происходят взаимопревращения
пиридоксальфосфата и пиридоксаминфосфата, в частности в реакциях
трансаминирования и декарбоксилирования аминокислот (см. главу 12).
Следует отметить, что в выяснение биологической роли витамина В6
и пиридоксальфосфата в азотистом обмене существенный вклад внесли
А.Е. Браунштейн, С.Р. Мардашев, Э. Снелл, Д. Мецлер, А. Майстер и др.
Известно более 20 пиридоксалевых ферментов, катализирующих ключевые
реакции азотистого метаболизма во всех живых организмах. Так доказано,
что пиридоксальфосфат является простетической группой аминотранс-
фераз, катализирующих обратимый перенос аминогруппы (NH2-группы)
от аминокислот на α-кетокислоту, и декарбоксилаз аминокислот, осу-
ществляющих необратимое отщепление СО2 от карбоксильной группы
аминокислот с образованием биогенных аминов. Установлена кофер-
ментная роль пиридоксальфосфата в ферментативных реакциях неокисли-
тельного дезаминирования серина и треонина, окисления триптофана,
кинуренина, превращения серосодержащих аминокислот, взаимопревраще-
ния серина и глицина (см. главу 12), а также в синтезе δ-аминолевулиновой
кислоты, являющейся предшественником молекулы гема гемоглобина, и др.
Пиридоксин относится к витаминам, коферментная роль которых изучена
наиболее подробно. В последние годы число вновь открытых пиридокса-
левых ферментов быстро увеличивалось. Так, для действия гликогенфос-
форилазы существенной оказалась фосфорильная, а не альдегидная группа
пиридоксальфосфата. Вследствие широкого участия пиридоксальфосфата
в процессах обмена при недостаточности витамина В6 отмечаются разно-
образные нарушения метаболизма аминокислот.
23.Тетрагидрофолиевая кислота.
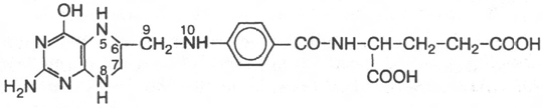
Фолиевая кислота,Транспорт одноуглеродных групп.
Коферментные функции фолиевой кислоты связаны
не со свободной формой витамина, а с восстановленным его птеридиновым
производным. Восстановление сводится к разрыву двух двойных связей
и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8
с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает
в 2 стадии в животных тканях при участии специфических ферментов,
содержащих восстановленный НАДФ. Сначала при действии фолатредук-
тазы образуется дигидрофолиевая кислота (ДГФК), которая при участии
второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК:
ФК + НАДФН + Н+ <=> ДГФК + НАДФ+;
ДГФК + НАДФН + Н+ <=> ТГФК + НАДФ+
Доказано, что коферментные функции ТГФК непосредственно связаны
с переносом одноуглеродных групп, первичными источниками которых
в организме являются β-углеродный атом серина, α-углеродный атом
Фолиевая (птероилглутаминовая) кислота
5,6,7,8-Тетрагидрофолиевая кислота (ТГФК)
глицина, углерод метальных групп метионина, холина, 2-й углеродный
атом индольного кольца триптофана, 2-й углеродный атом имидазольного
кольца гистидина, а также формальдегид, муравьиная кислота и метанол.
К настоящему времени открыто шесть одноуглеродных групп, включа-
ющихся в разнообразные биохимические превращения в составе ТГФК:
формильная (—СНО), метильная (—СН3), метиленовая (—СН2—),
метенильная (—СН=), оксиметильная (—СН2ОН) и формими-
новая (—CH=NH). Выяснено, что присоединение этих фрагментов к
ТГФК является ферментативной реакцией ковалентного связывания их
с 5-м или 10-м атомом азота (или с обоими атомами вместе). В качестве
примера приводим отдельные функциональные группы в активных участках
ТГФК:
Имеются данные, что производные ТГФК участвуют в переносе одно-
углеродных фрагментов при биосинтезе метионина и тимина (перенос
метильной группы), серина (перенос оксиметильной группы), образовании
пуриновых нуклеотидов (перенос формильной группы) и т.д. (см. главы 12
и 13). Перечисленные вещества играют исключительно важную, ключевую,
роль в биосинтезе белков и нуклеиновых кислот, поэтому становятся
понятными те глубокие нарушения обмена, которые наблюдаются при
недостаточности фолиевой кислоты.
В медицинской практике (в частности, в онкологии) нашли применение
некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так,
4-аминоптерин используется в качестве препарата, тормозящего синтез
нуклеиновых кислот, и рекомендуется в качестве лечебного препарата при
опухолевых поражениях, в частности при острых и хронических формах
лейкозов у детей и взрослых.
24.Биотин.
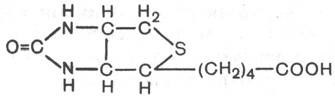
Витамин Н,кофермент карбоксилирования.
Биотин подробно изучен благодаря работам
Ф. Линена. Известные к настоящему времени биотиновые ферменты (т.е.
ферменты, содержащие в качестве кофермента биотин) катализируют два
типа реакций:
1) реакции карбоксилирования (с участием СО2 или НСО3
–), сопря-
женные с распадом АТФ
RH + HCO3
– + АТФ <=> R-COOH + АДФ + Н3РО4;
2) реакции транскарбоксилирования (протекающие без участия АТФ),
при которых субстраты обмениваются карбоксильной группой
R1-COOH + R2H <=> R1H + R2-COOH.
Получены доказательства двустадийного механизма этих реакций с
образованием промежуточного комплекса (карбоксибиотинилфермент).
К реакциям первого типа относятся, например, ацетил-КоА- и пируват-
карбоксилазные реакции:
CH3–CO–S-KoA + CO2 + АТФ <=> HOOC–CH2–CO–KoA + АДФ + Pi.
Пируваткарбоксилаза является высокоспецифичным ферментом, ката-
лизирующим уникальную реакцию усвоения СО2 в организме животных.
Сущность реакции сводится к пополнению запасов оксалоацетата (щаве-
левоуксусная кислота) в лимоннокислом цикле (так называемые «анаплеро-
тические», «пополняющие» реакции), т.е. его синтезу из СО2 и пирувата:
Пируват + CO2 + АТФ + H2O —> Оксалоацетат + АДФ + Pi + 2H+
Реакция протекает в две стадии: на первой стадии, связанной с затратой
энергии, СО2 подвергается активированию, т.е. ковалентному связыванию
с биотином в активном центре фермента (Е-биотин):
CO2 + Биотин + АТФ + H2O Биотин + АДФ + Pi + 2H+
На второй стадии СО2 из комплекса переносится на пируват с об-
разованием оксалоацетата и освобождением фермента:
Примером второго типа реакций является метилмалонил-оксалоаце-
тат-транскарбоксилазная реакция, катализирующая обратимое превраще-
ние пировиноградной и щавелевоуксусной кислот:
Реакции карбоксилирования и транскарбоксилирования имеют важное
значение в организме при синтезе высших жирных кислот, белков, пури-
новых нуклеотидов (соответственно нуклеиновых кислот) и др.
25. Активный центр ферментов
При изучении механизма химической реакции, катализируемой фермента-
ми, исследователя всегда интересует не только определение промежуточных
и конечных продуктов и выяснение отдельных стадий реакции, но и природа
тех функциональных групп в молекуле фермента, которые обеспечивают
специфичность действия фермента на данный субстрат (субстраты) и высо-
кую каталитическую активность. Речь идет, следовательно, о точном
знании геометрии и третичной структуры фермента, а также химической
природы того участка (участков) молекулы фермента, который обеспе-
чивает высокую скорость каталитической реакции. Участвующие в фер-
ментативных реакциях молекулы субстратов часто имеют небольшие раз-
меры по сравнению с молекулами ферментов, поэтому было высказано
предположение, что при образовании фермент-субстратных комплексов
в непосредственный контакт с молекулой субстрата, очевидно, вступает
ограниченная часть аминокислот пептидной цепи. Отсюда возникло пред-
ставление об активном центре фермента. Под активным центром
подразумевают уникальную комбинацию аминокислотных остатков в мо-
лекуле фермента, обеспечивающую непосредственное связывание ее с мо-
лекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено,
что у сложных ферментов в состав активного центра входят также просте-
тические группы.
В активном центре условно различают так называемый каталити-
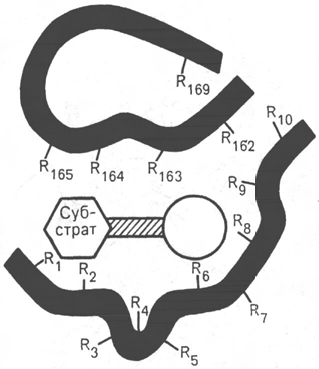
Рис. 4.2. Активный центр фер-
мента (схема) (по Малеру и
Кордесу).
Темные полосы - участки полипеп-
тидной цепи фермента; R - амино-
кислотные остатки и их порядковые
номера (с N-конца).
ческий центр, непосредственно вступающий в химическое взаимодейст-
вие с субстратом, и связывающий центр, или контактную («якор-
ную») площадку, которая обеспечивает специфическое сродство к субст-
рату и формирование его комплекса с ферментом. В свою очередь молекула
субстрата также содержит функционально различные участки: например,
субстраты эстераз или протеиназ – одну специфическую связь (или группу
атомов), подвергающуюся атаке со стороны фермента, и один или несколь-
ко участков, избирательно связываемых ферментом.
Получены экспериментальные доказательства наличия в активном цент-
ре химотрипсина двух остатков гистидина и остатка серина, схематически
представленных в трехмерной структурной модели предшественника этого
фермента (рис. 4.3). Выявление химической природы и вероятной топогра-
фии групп активного центра – проблема первостепенной важности. Она
сводится к определению природы аминокислот, их последовательности
и взаиморасположения в активном центре. Для идентификации так назы-
ваемых существенных аминокислотных остатков используют специфиче-
ские ингибиторы ферментов (часто это субстратподобные вещества или
аналоги коферментов), методы «мягкого» (ограниченного) гидролиза в со-
четании с химической модификацией, включающей избирательное окисле-
ние, связывание, замещение остатков аминокислот и др.
При помощи методов ингибиторного анализа были предприняты по-
пытки установить закономерности состава и структуры активных центров
у ферментов, относящихся к разным группам. В частности, при использо-

Связывающий центр,активный центр
Активный центр
Молекула химотрипсина
вании диизопропилфторфосфата (ДФФ), принадлежащего к так называе-
мым нервным ядам, наблюдается полное выключение активного центра
холинэстеразы – фермента, катализирующего гидролиз ацетилхолина на
холин и уксусную кислоту. Оказалось, что этот ингибитор имеет близкое
структурное сходство с ацетилхолином и подобно ему взаимодействует
с ОН-группой остатка серина в активном центре. Вызывая фосфори-
лирование серина в активном центре ряда других ферментов, ДФФ также
инактивирует их действие:
Показано, что ДФФ избирательно фосфорилирует в каждом чувстви-
тельном к нему ферменте только один остаток серина, наделенный
функциональной активностью. Учитывая этот механизм действия ДФФ,
сделаны попытки определения природы аминокислот в окружении «ка-
талитического» остатка серина у ряда ферментов (табл. 4.2).
Из данных табл. 4.2 видно, что ферменты, сходные по типу действия,
хотя и различаются специфичностью, могут иметь почти одинаковую
последовательность аминокислотных остатков в тех участках, которые
примыкают к остатку серина, несущему функционально активную гидро-
ксильную группу. Существенное значение ОН-группы серина для акта
катализа было доказано, кроме того, химическим ее блокированием или
удалением, когда эстеразы полностью лишались ферментативной актив-
ности.
Активный фермент ДФФ Неактивный фермент
Фермент
Химотрипсин
Трипсин
Тромбин
Эластаза
Бутирилхолинэстераза
Ацетилхолинэстераза
Алиэстераза печени
Щелочная фосфатаза (E. coli)
Субтилизин (В. subtilis)
Протеаза (Aspergillius orizae)
Фосфоглюкомутаза
Фосфорилаза
Последовательность остатков
аминокислот вокруг серина
—Гли—Асп—Сер—Гли—Гли—
—Гли—Асп—Сер—Гли—Про—Вал—
—Асп—Сер—Гли—
—Асп—Сер—Гли—
—Гли—Глу—Сер—Ала—
—Глу—Сер—Ала—
—Гли—Глу—Сер—Ала—Гли—Гли—
—Тре—Асп—Сер—Ала—Сер—Ала—
—Гли—Тре—Сер—Мет—Ала—
—Тре—Сер—Мет—Ала—
—Тре—Ала—Сер—Гис—Асп—
—Глн—Иле—Сер—Вал—Apг—
Предполагают, что формирование активного центра фермента начи-
нается уже на ранних этапах синтеза белка-фермента (см. главу 14) на
рибосоме, когда линейная одномерная структура пептидной цепи превра-
щается в трехмерное тело строго определенной конфигурации. Образо-
вавшийся белок приобретает информацию совершенно нового типа, а
именно функциональную (в частности, каталитическую). Любые воздейст-
вия, приводящие к денатурации, т.е. нарушению третичной структуры,
приводят к искажению или разрушению структуры активного центра
и соответственно потере ферментом каталитических свойств. Если при
подходящих внешних условиях удается восстановить нативную трехмерную
структуру белка-фермента (ренатурировать его), то восстанавливается и его
каталитическая активность. Это было показано впервые на примере рибо-
нуклеазы поджелудочной железы
26.
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Влияние закона действия масс. В катализируемой ферментом обратимой
химической реакции, например А + В <=> С + D, концентрация компонентов
реакции и соответственно направление реакции будут регулироваться влия-
нием закона действия масс. Оно, в частности, может быть показано
в обратимой реакции трансаминирования, катализируемой ферментом
аланинаминотрансферазой:
Аланин + α-Кетоглутарат <=> Пируват + Глутамат.
Этот тип регуляции играет, очевидно, лишь ограниченную роль, по-
скольку в реальных условиях реакция обычно протекает в одном направле-
нии, так как образовавшиеся продукты могут оказаться субстратами для
действия других ферментов и выводиться из сферы реакции. В этих случаях
устанавливается скорее устойчивое (стационарное) состояние, чем истинное
равновесие.
Изменение количества фермента. На бактериях хорошо изучен феномен
индуцированного (индуцирующего) синтеза ферментов при выращи-
вании их на среде, где единственным источником углерода и энергии служит
тот или иной углевод, например глюкоза. Замена в среде глюкозы на
лактозу (индуктор) приводит к индуцированному или адаптивному (после
небольшого периода лаг-фазы) синтезу фермента галактозидазы (програм-
мированному лактозным геном, см. главу 13), расщепляющей лактозу на
глюкозу и галактозу.
В клетках прокариот и эукариот имеются ферменты, концентрация
которых не требует добавления индуктора; это так называемые консти-
тутивные ферменты. Количество фермента в клетке зависит от наличия
продукта реакции, катализируемой данным ферментом, причем продукт
реакции вызывает торможение синтеза фермента в результате репрессии
(В животных тканях быстрый синтез ферментов наблюдается реже.
Механизм его (индуцирующий синтез) изучен только для небольшого
числа ферментов: тирозинтрансаминазы, серин- и треониндегидратазы,
триптофанпирролазы и др. – в ответ на введение гормонов или прием
белковой пищи. Однако при поступлении в организм некоторых ядов,
канцерогенных веществ, алкалоидов, инсектицидов через несколько дней
наблюдается резкое повышение активности (соответственно количества)
ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети
клеток печени, окисляющих чужеродные вещества в нетоксичные для
организма продукты. Вполне допустимо предположить, что в этих случаях
имеет место синтез ферментов путем индукции (т.е. de novo). Описаны
случаи, когда под действием подобных гидроксилаз чужеродные вещества
превращаются в организме в более токсичные соединения. Это явление,
обратное детоксикации, получило название летального синтеза.
Проферменты. Протеолитические ферменты пищеварительного тракта,
а также поджелудочной железы синтезируются в неактивной форме – в виде
проферментов (зимогенов). Регуляция в этих случаях сводится к пре-
вращению проферментов в активные ферменты под влиянием специфи-
ческих агентов или других ферментов – протеиназ. Так, трипсин в под-
желудочной железе синтезируется в форме неактивного трипсиногена.
Поступив в кишечник, он превращается в активный трипсин в результате
аутокатализа или под действием других протеиназ (механизм активации
подробно рассматривается в главе 12). Превращение неактивного пепси-
ногена в активный пепсин происходит аутокаталитически в результате
специфического ограниченного протеолиза в присутствии соляной кислоты
и также связано с отщеплением от профермента специфического ингибитора
пептидной природы. Эти превращения зимогенов в активные ферменты
связаны с конформационными изменениями молекулы фермента и форми-
рованием активного центра или его раскрытием (демаскирование). Синтез
протеиназ в неактивной форме и ряда других неактивных белков-пред-
шественников имеет, очевидно, определенный биологический смысл, пре-
дотвращая разрушение клеток органов, в которых образуются профер-
менты.
Химическая модификация фермента. Некоторые белки при формиро-
вании третичной структуры подвергаются постсинтетической химической
модификации Оказалось, что активность ряда ключевых
ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы
и др., также контролируется путем фосфорилирования и дефосфорили-
рования, осуществляемого специфическими ферментами – протеинкиназой
и протеинфосфатазой, активность которых в свою очередь регулируется
гормонами .Уровень активности ключевых ферментов обмена
углеводов и соответственно интенсивность и направленность самих про-
цессов обмена определяются соотношением фосфорилированных и де-
фосфорилированных форм этих ферментов.
Обычно различают обратимую ковалентную и нековалентную хими-
Дата добавления: 2015-04-05; просмотров: 981;
