СУЩНОСТЬ, ЦЕЛИ И ЗАДАЧИ МАРКЕТИНГА 1 страница
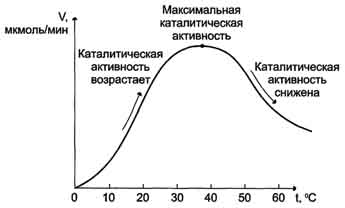
реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы (рис. 2-17).
Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
9. Зависимость скорости ферментативной реакции от количества субстрата
Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой (рис. 2-19).
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г.
Ферментативный процесс можно выразить следующим уравнением:

где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
V =
| Vmax[S] |
| Km + [S] |
Это уравнение получило название уравнения Михаэлиса-Ментен.
В случае, когда скорость реакции равна половине максимальной, Km = [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна
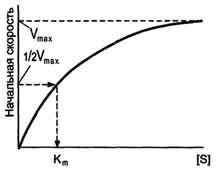
Рис. 2-19. Зависимость скорости реакции (V) от концентрации субстрата S. Vmax - максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции. Кm - константа Михаэлиса.
концентрации субстрата (реакция имеет первый порядок).
Vmах и Km - кинетические характеристики эффективности фермента.
· Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше
· Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
На рис. 2-20 представлена зависимость скорости двух ферментативных реакций (1 и 2) от концентрации субстрата. Константа Михаэлиса первого фермента меньше константы Михаэлиса второго фермента (Kml < Km2). Следовательно, сродство первого фермента к субстрату выше, чем у второго фермента, и начальная скорость реакции, катализируемой первым ферментом, выше в сравнении со вторым ферментом.
10.
11. Скорость ферментативной реакции, как и активность фермента, в значи-
тельной степени определяется также присутствием в среде активаторов
и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту
реакцию. Активирующее влияние на скорость ферментативной реакции
оказывают разнообразные вещества органической и неорганической приро-
ды. Так, соляная кислота активирует действие пепсина желудочного сока;
Количество продукта
Время
Повышение
концентрации фермента
4х
3х
2х
1х
желчные кислоты повышают активность панкреатической липазы; неко-
торые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), расти-
тельная протеиназа и др. в значительной степени активируются соеди-
нениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд
ферментов – также витамином С. Особенно часто активаторами выступают
ионы двухвалентных и, реже, одновалентных металлов. Получены дока-
зательства, что около четверти всех известных ферментов для проявления
полной каталитической активности нуждаются в присутствии металлов.
Многие ферменты вообще не активны в отсутствие металлов. Так, при
удалении цинка угольная ангидраза (карбоангидраза), катализирующая
биосинтез и распад Н2СО3, практически теряет свою ферментативную
активность; более того, цинк при этом не может быть заменен никаким
другим металлом. Известны ферменты *, действие которых активируется
ионами нескольких металлов; в частности, енолаза активируется Mg2+,
Mn2+, К+ (табл. 4.4).механизм действия металлов в энзиматическом катализе,
или роль металлов в активировании ферментами. В ряде случаев ионы
металлов (Со2+, Mg2+, Zn2+, Fe2+) выполняют функции простетических
групп ферментов, или служат акцепторами и донаторами электронов, или
выступают в качестве электрофилов либо нуклеофилов, сохраняя реактив-
ные группы в необходимой ориентации. В других случаях они способствуют
присоединению субстрата к активному центру и образованию фермент-
субстратного комплекса. Например, ионы Mg2+ через отрицательно заря-
женную фосфатную группу обеспечивают присоединение монофосфатных
эфиров органических веществ к активному центру фосфатаз, катализирую-
щих гидролиз этих соединений. Иногда металл соединяется с субстратом,
образуя истинный субстрат, на который действует фермент. В частности,
ионы Mg2+ активируют креатинфосфокиназу благодаря образованию ис-
тинного субстрата – магниевой соли АТФ. Наконец, имеются эксперимен-
тальные доказательства прямого участия металлов (например, ионов Са2+
* Обычно трудно провести границу между металлоферментами (когда металл связан
прочно с белком и незаменим) и ферментами, активируемыми металлами (последние лишь
ускоряют реакцию и легко диссоциируют).в молекуле амилазы слюны) в формировании и стабилизации активного
центра и всей трехмерной структуры молекулы фермента. Следует отме-
тить также, что металлы нередко выступают в роли аллостерических
модуляторов (эффекторов; см. рис. 4.22). Взаимодействуя с аллостеричес-
ким центром, подобный металл (эффектор) способствует образованию
наиболее выгодной пространственной конфигурации фермента и активного
фермент-субстратного комплекса.
Анионы в физиологических концентрациях обычно неэффективны или
оказывают небольшое активирующее влияние на ферменты. Исключение
составляют пепсин, некоторые оксидоредуктазы, активируемые анионами,
а также амилаза слюны, катализирующая гидролиз крахмала, активность
которой повышается при действии ионов хлора, и аденилатциклаза, кото-
рая активируется анионами галогенов.
12. Ингибиторы ферментов обычно принято делить на два больших
класса: обратимые и необратимые. Это вещества, вызывающие частичное
(обратимое) или полное торможение реакций, катализируемых фермента-
ми. Недавно открыты антиферменты (антиэнзимы, или антизимы),
представляющие собой белки (или полипептиды), действующие как инги-
биторы ферментов. К подобным веществам относятся, например, инги-
битор трипсина, обнаруженный в соевых бобах, и сывороточный анти-
трипсин. Недавно открыт в печени животных антифермент орнитинде-
карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-
диссоциируемые комплексы с соответствующими ферментами, выключая
их из химических реакций. Иногда ингибитор является составным компо-
нентом предшественника фермента, например пепсина (см. главу 12), или
входит в состав сложных комплексов ферментов, например в состав
протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-
рилирования-дефосфорилирования в живых организмах. Однако до сих
пор не выяснено, являются ли подобные антиферменты истинными инги-
биторами или регуляторными субъединицами, в частности, какова разница
в назначении регуляторной (R) субъединицы в составе протеинкиназы
и ингибиторной (I) субъединицы в составе протеинфосфатазы.
Ферменты являются белками, поэтому любые агенты, вызывающие
денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание),
приводят к необратимой инактивации фермента. Однако подобное инак-
тивирование относительно неспецифично, оно не связано с механизмом
действия ферментов. Гораздо большую группу составляют так называемые
специфические ингибиторы, которые оказывают свое действие на какой-
либо один фермент или группу родственных ферментов, вызывая обрати-
мое или необратимое ингибирование. Исследование этих ингибиторов
имеет важное значение. Во-первых, ингибиторы могут дать ценную инфор-
мацию о химической природе активного центра фермента, а также о составе
его функциональных групп и природе химических связей, обеспечивающих
образование фермент-субстратного комплекса. Известны вещества, вклю-
чая лекарственные препараты, специфически связывающие ту или иную
функциональную группу в молекуле фермента, выключая ее из химической
реакции. Так, йодацетат IСН2—СООН, его амид и этиловый эфир, пара-
хлормеркурибензоат ClHg—С6Н4—СООН и другие реагенты сравнитель-
но легко вступают в химическую связь с некоторыми SH-группами фер-
ментов. Если такие группы имеют существенное значение для акта ката-
лиза, то добавление подобных ингибиторов приводит к полной потере
активности фермента:
R-SH + IСН2—СООН —> НI + R—S—CH2—COOH
Действие ряда других ферментов (холинэстераза, трипсин и химотрип-
син) сильно тормозится некоторыми фосфорорганическими соединениями,
например ДФФ, вследствие блокирования ключевой гидроксильной группы
серина в активном центре (см. ранее).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при
исследовании природы множественных форм ферментов и изоферментов,
различающихся не столько электрофоретической подвижностью, сколько
различной чувствительностью к одному и тому же ингибитору.
При помощи ингибиторов, выключающих отдельные стадии многосту-
пенчатого метаболического процесса, могут быть точно установлены не
только последовательность химических реакций, но и природа участвую-
щих в этих превращениях ферментов. Этим путем, применяя йодацетат,
фториды и другие специфические ингибиторы, был расшифрован глико-
литический путь окислительно-восстановительных превращений глюкозы
до стадии образования молочной кислоты в мышечной ткани, насчиты-
вающий 11 стадий с участием 11 ферментов и 10 промежуточных ме-
таболитов.
С ингибированием ферментов связан механизм действия многих токси-
нов и ядов на организм. Известно, что при отравлениях солями сенильной
кислоты смерть наступает вследствие полного торможения и выключения
дыхательных ферментов (цитохромная система) тканей, особенно клеток
мозга. Токсическое влияние на организм человека и животных некоторых
инсектицидов обусловлено торможением активности холинэстеразы – фер-
мента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направлен-
ное применение лекарственных препаратов в медицине) должна основы-
ваться на точном знании механизма действия лекарственных средств на
биосинтез ферментов, на активность уже синтезированных ферментов или
на регуляцию их активности в организме. Иногда для лечения некоторых
болезней используют избирательно действующие ингибиторы. Так, инги-
битор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол
широко применяется для лечения острого панкреатита – болезни, при ко-
торой уровень трипсина и химотрипсина в крови резко возрастает. Знание
избирательного ингибиторного действия некоторых природных и синте-
тических соединений (так называемых антиметаболитов) на ферменты
может служить методологической основой для разработки эффективных
методов синтеза химиотерапевтических препаратов. Этот путь открывает
широкие возможности для направленного воздействия на синтез ферментов
в организме и регуляции интенсивности метаболизма при патологии.
Типы ингибирования. Различают обратимое и необратимое ингибиро-
вание. Если ингибитор вызывает стойкие изменения пространственной
третичной структуры молекулы фермента или модификацию функциональ-
ных групп фермента, то такой тип ингибирования называется необрати-
мым. Чаще, однако, имеет место обратимое ингибирование, под-
дающееся количественному изучению на основе уравнения Михаэлиса-
Ментен. Обратимое ингибирование в свою очередь разделяют на кон-
курентное и неконкурентное в зависимости от того, удается или не удается
преодолеть торможение ферментативной реакции путем увеличения кон-
центрации субстрата.
Конкурентное ингибирование.
Неконкурентное ингибирование вызывается веществами, не
имеющими структурного сходства с субстратами и часто связывающимися
не с активным центром, а в другом месте молекулы фермента. Степень
торможения во многих случаях определяется продолжительностью дейст-
вия ингибитора на фермент. При данном типе ингибирования благодаря
образованию стабильной ковалентной связи фермент часто подвергается
полной инактивации, и тогда торможение становится необратимым. При-
мером необратимого ингибирования является действие йодацетата, ДФФ,
а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это
действие заключается в связывании и выключении функциональных групп
или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть
обратимым и необратимым, поскольку отсутствует конкуренция между
субстратом и ингибитором за активный центр. Примеры необратимого
ингибирования приведены ранее. При обратимом неконкурентном
ингибировании субстрат S и ингибитор I связываются с разными
центрами, поэтому появляется возможность образования как комплекса EI,
так и тройного комплекса EIS; последний может распадаться с осво-
бождением продукта, но с меньшей скоростью, чем комплекс ES.
Этот тип неконкурентного ингибирования чаще всего наблюдается
у ферментов, катализирующих превращения более одного субстрата, когда
связывание ингибитора не блокирует связывание субстрата с активным
центром. Ингибитор при этом соединяется как со свободным ферментом,
так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингиби-
рование, когда ингибитор связывается с ферментом также в некатали-
тическом центре, однако не со свободным ферментом, а только с ES-комп-
лексом в виде тройного комплекса.
Для выяснения вопроса о типе ингибирования пользуются уравнениями
Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравне-
нием Эди-Хофсти:
v = –Km(v/[S]) + Vmax
и соответствующими графиками в прямолинейных координатах.
При конкурентном типе ингибирования ингибитор увеличивает значение
Кm, не оказывая влияния на максимальную скорость Vmax (рис. 4.21). Это
означает, что при достаточно высокой концентрации субстрата [S] ин-
гибитор вытесняется молекулами субстрата из комплекса EI. При некон-
курентном ингибировании (рис. 4.22) ингибитор снижает величину макси-
мальной скорости. Если при этом величина Кm не уменьшается, то говорят
о полностью неконкурентном ингибировании. Подобный тип ингибиро-
вания имеет место при образовании неактивных, труднодиссоциирующих
комплексов EI и(или) EIS. Часто, однако, наблюдается смешанный тип
ингибирования, иногда называемый частично неконкурентным, или обра-
тимым неконкурентным ингибированием (см. ранее), при котором сни-
жение Vmax сочетается с одновременным увеличением значений Кm. Это
означает, что комплекс EI сохраняет частичную активность, т.е. способ-
ность к образованию промежуточного тройного комплекса EIS, в котором
субстрат подвергается
13.
Конкурентное ингибирование может быть вызвано веществами,
имеющими структуру, похожую на структуру субстрата, но несколько
отличающуюся от структуры истинного субстрата. Такое ингибирование
основано на связывании ингибитора с субстратсвязывающим (активным)
центром. Классическим примером подобного типа ингибирования является
торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фер-
мент катализирует окисление путем дегидрирования янтарной кислоты
(сукцината) в фумаровую:
Если в среду добавить малонат (ингибитор), то в результате структур-
ного сходства его с истинным субстратом сукцинатом (наличие двух таких
же ионизированных карбоксильных групп) он будет взаимодействовать
с активным центром с образованием фермент-ингибиторного комплекса,
однако при этом полностью исключается перенос атома водорода от
малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же
несколько различаются. Поэтому они конкурируют за связывание с актив-
ным центром, и степень торможения будет определяться соотношением
концентраций малоната и сукцината, а не абсолютной концентрацией
ингибитора. Таким образом, ингибитор может обратимо связываться
с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингиби-
рования иногда называют ингибированием по типу метаболического анта-
гонизма .
В общей форме реакция взаимодействия ингибитора с ферментом может
быть представлена следующим уравнением:
Образовавшийся комплекс, называемый фермент-ингибиторным комп-
лексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается
с образованием продуктов реакции. Константу диссоциации комплекса EI,
или ингибиторную константу Кi, можно, следуя теории Михаэлиса–Мен-
тен, определить как отношение констант обратной и прямой реакций:
т.е. ингибиторная константа прямо пропорциональна произведению кон-
центрации фермента и ингибитора и обратно пропорциональна концент-
рации комплекса EI.
Метод конкурентного торможения нашел широкое применение в ме-
дицинской практике. Известно, например, что для лечения некоторых
инфекционных заболеваний, вызываемых бактериями, применяют сульфа-
ниламидные препараты. Оказалось, что эти препараты имеют структурное
сходство с парааминобензойной кислотой, которую бактериальная клетка
использует для синтеза фолиевой кислоты, являющейся составной частью
ферментов бактерий. Благодаря этому структурному сходству сульфани-
ламид блокирует действие фермента путем вытеснения парааминобензой-
ной кислоты из комплекса с ферментом, синтезирующим фолиевую кисло-
ту, что ведет к торможению роста бактерий.
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности
дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурент-
ные, так называемые коферментные, ингибиторы (или антивитамины),
тормозящие многие интенсивно протекающие при патологии биологи-
ческие процессы в организме. Применение подобных аналогов в меди-
цинской практике (в частности, в дерматологии и онкологии) основано на
конкурентном вытеснении коферментов из субстратсвязывающих центров
ключевых ферментов обмена.
14.неконкурентное
Неконкурентное ингибирование вызывается веществами, не
имеющими структурного сходства с субстратами и часто связывающимися
не с активным центром, а в другом месте молекулы фермента. Степень
торможения во многих случаях определяется продолжительностью дейст-
вия ингибитора на фермент. При данном типе ингибирования благодаря
образованию стабильной ковалентной связи фермент часто подвергается
полной инактивации, и тогда торможение становится необратимым. При-
мером необратимого ингибирования является действие йодацетата, ДФФ,
а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это
действие заключается в связывании и выключении функциональных групп
или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть
обратимым и необратимым, поскольку отсутствует конкуренция между
субстратом и ингибитором за активный центр. Примеры необратимого
ингибирования приведены ранее. При обратимом неконкурентном
ингибировании субстрат S и ингибитор I связываются с разными
центрами, поэтому появляется возможность образования как комплекса EI,
так и тройного комплекса EIS; последний может распадаться с осво-
бождением продукта, но с меньшей скоростью, чем комплекс ES.
Е + S àESàE+P
+ +
I I
ЕI+ SàESI
Этот тип неконкурентного ингибирования чаще всего наблюдается
у ферментов, катализирующих превращения более одного субстрата, когда
связывание ингибитора не блокирует связывание субстрата с активным
центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ES комплексом.
15.Ингибиторы-лекарства,
Лекарственные препараты, применяемые с целью подавления активности ферментов, называются ингибиторами ферментов.
Классификация
1. Ингибиторы протеиназ: контрикал.
2. Ингибиторы фибринолиза: кислота амино-капроновая.
3. Антихолинэстеразные средства: прозерин, физостигмина салицилат, галантамина гидробромид и др.
4. Ингибиторы МАО: ниаламид.
5. Ингибиторы карбоангидразы: диакарб.
6. Ингибиторы ксантиноксидазы: аллопуринол.
7. Ингибиторы ацетальдегидрогеназы: циамид, тетурам (дисульфирам) и др.
Контрикал — антиферментный препарат, ингибирующий активность трипсина, калликреина, плазмина.
Фармакокинетика: при внутривенном введении действие развивается через 10—15 мин.
Показания к применению: острый панкреатит, панкреанекроз в сочетании с гепарином в острый период инфаркта миокарда.
Противопоказания: с осторожностью у лиц, склонных к аллергическим реакциям.
Побочные эффекты: аллергические реакции.
16. Под коферментом часто подразумевают дополнительную группу,
легко отделяемую от апофермента при диссоциации. Предполагают, что
простетическая группа может быть связана с белком ковалентными и неко-
валентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы ко-
фактор биотин ковалентно связан с апоферментом посредством амидной
связи (см. главу 7). С другой стороны, химические связи между кофакто-
рами и пептидными цепями могут быть относительно слабыми (например,
водородные связи, электростатические взаимодействия и др.). В таких
случаях при выделении ферментов наблюдается полная диссоциация обеих
частей, и изолированый белковый компонент оказывается лишенным фер-
ментативной активности, пока не будет добавлен извне недостающий
кофактор. Именно к подобным изолированным низкомолекулярным орга-
ническим веществам применим термин «кофермент», типичными предста-
вителями которых являются витамины В1, В2, В6, РР, содержащие кофер-
менты. Известно также, что и простетические группы, и коферменты
активно включаются в химические реакции, выполняя функции промежу-
тоных переносчиков электронов, атомов водорода или различных функцио-
нальных групп (например, аминных, ацетильных, карбоксильных). В подоб-
ных случаях кофермент рассматривают в качестве второго субстрата, или
косубстрата.
Роль кофермента (Ко) в качестве переносчика, например, атомов водо-
рода может быть представлена в виде схемы, где SH – субстрат, КоЕ – хо-
лофермент, А – акцептор протона:
SHКoЕ AH
S КоЕН A
Субстрат подвергается окислению, отдавая электроны и протоны,
а КоЕ – восстановлению, принимая электроны и протоны. В следующей
полуреакции восстановленный КоЕН может отдавать электроны и протоны
на какой-либо другой промежуточный переносчик электронов и протонов
или на конечный акцептор (см. главу 9).
Коэнзим, кофактор, простетическая группа – двусмысленный биохими-
ческий жаргон. До сих пор продолжается терминологический спор, по-
скольку часто определения «коэнзим», «кофактор» и «простетическая груп-
па» рассматриваются через призму их роли в реакциях энзиматического
(ферментативного) катализа. Следует, однако, считаться с тем неоспо-
римым фактом, что во многих случаях небелковые органические молекулы,
как и ионы металлов, абсолютно необходимы белковому компоненту при
выполнении определенной биологической функции, не имеющей отношения
к биокатализу. Несомненно, имеют значение также тип и характер связи
небелкового компонента с молекулой белка. Поэтому очевидно, что ко-
фактором может служить любой фактор, абсолютно необходимый для
выполнения белком его каталитической или любой другой биологической
роли. С другой стороны, коферментом может быть любой небелковый
фактор, который непосредственно вовлечен в реакцию энзиматического
катализа. Кофактор, который непосредственно не участвует в акте ката-
Дата добавления: 2015-04-05; просмотров: 943;
