Строение реальных веществ.
Законы идеальных газов (ИГ) – приближенные законы. При описании реальных газов, в отличие от ИГ, для получения действительных значений параметров состояния необходимо учитывать собственный объем молекул и межмолекулярное взаимодействие. Особенно заметно различие измеряемых значений параметров реальных газов и получаемых из уравнения Менделеева–Клапейрона при низких температурах и высоких давлениях (высокой концентрации, а следовательно, собственном объеме молекул газа, сравнимом с объемом занимаемого сосуда).
Способность твердых тел (ТТ) сопротивляться растяжению и газов сопротивляться сжатию приводит к выводу о существовании сил взаимного притяжения и отталкивания между молекулами вещества, причем на малых расстояниях преобладают силы отталкивания, а с увеличением расстояния – силы притяжения. Данные силы являются короткодействующими. Радиус их действия ориентировочно ~10-9 м, т.к. нельзя говорить о равенстве сил взаимодействия нулю вне сферы молекулярного действия, а лишь об их сравнительно малом значении (быстро, ~r -7, убывают с увеличением расстояния, см. рис. 13.1,а). Так как изменение потенциальной энергии
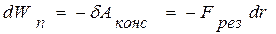 ,
,
то
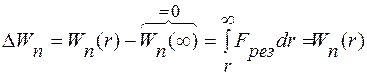 .
.
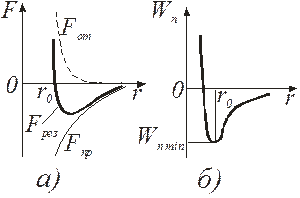
Рис. 13.1
Графически зависимость Wn(r) представлена на рис. 13.1, б. При условии
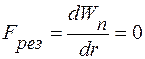 (13.1)
(13.1)
осуществляется состояние равновесия, которое характеризуется минимумом потенциальной энергии. В общем случае в природе система всегда стремится перейти в состояние, характеризуемое минимальной энергией.
Как известно, на одну степень свободы приходится энергия kT/2. Величина kT служит своеобразным критерием определения агрегатного состояния вещества: для газов Wn<<kT (интенсивное тепловое движение молекул), для ТТ Wn>>kT (атомы достаточно жестко фиксированы, лишь колеблются в узлах кристаллической решетки), для жидкостей Wn»kT (молекулы колеблются у одного положения равновесия в течение так называемого времени оседлой жизни и перескакивают из него в другое, что подтверждается броуновским движением).
Дата добавления: 2015-05-05; просмотров: 819;
