Политропные процессы.
Всякий процесс идеального газа, в котором теплоёмкость является постоянной величиной, называют политропным процессом, а линия процесса – политропой.
Основные термодинамические процессы – изохорный, изобарный, изотермический и адиабатный, если они протекают при постоянной теплоёмкости, являются частным случаем политропного процесса.
Теплоёмкость политропного процесса принимает значения из интервала
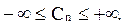
Количество теплоты участвующее в политропном процессе определяется формулой
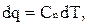
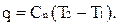
Используя уравнение первого закона термодинамики, получим уравнение политропного процесса.
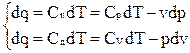 ,
,
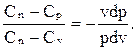
Обозначив
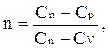
получим
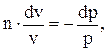
откуда
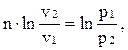
или
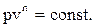
Полученное уравнение является уравнением политропного процесса.
Если n = 1 , то pV = const – изотермический процесс;
если n = 0 , то pV˚ = const, p = const – изобарный процесс;
если n = ± ∞ , то 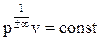 , v = const – изохорный процесс;
, v = const – изохорный процесс;
если n = k , то pvk = const – адиабатный процесс;
величина n – показатель политропы.
Аналогично адиабатному процессу можно записать
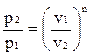 ,
, 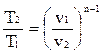 ,
, 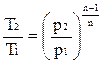 .
.
Используя формулу
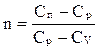 ,
,
получим
 .
.
Для изохорного процесса
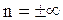 ,
, 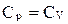 .
.
Для изобарного процесса
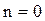 ,
, 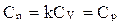 .
.
Для изотермического процесса
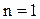 ,
, 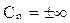 .
.
Для адиабатного процесса
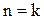 ,
, 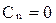 .
.
Уравнение работы изменения объема при политропном процессе аналогично уравнению работы при адиабатном процессе
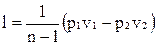 ,
,
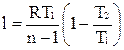 ,
,
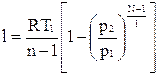 ,
,
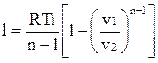 .
.
Изменение внутренней энергии и энтальпии в политропном процессе определяются формулами:
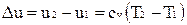 ;
;
 .
.
Теплота в политропном процессе определяется формулой
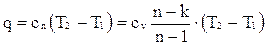 .
.
Располагаемая внешняя работа по аналогии с адиабатным процессом равна
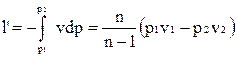 ,
,
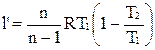 ,
,
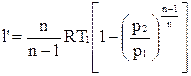 ,
,
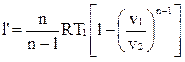 .
.
Зная координаты двух точек процесса можно определить значение n в любом политропном процессе:
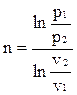 ;
; 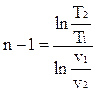 ;
; 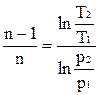 .
.
Используя логарифмические координаты можно легко определить показатель политропы
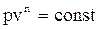
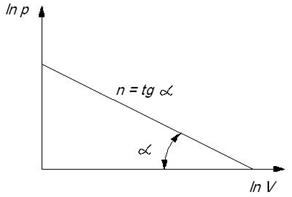
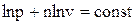 – прямая линия в координатах ln p и ln v;
– прямая линия в координатах ln p и ln v;
n – тангенс угла наклона прямой к оси абсцисс.
Изменение энтропии в политропном процессе определяется уравнением
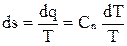 ,
,
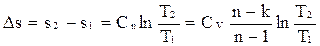 .
.
Представим политропные процессы в p-v и T-s – диаграммах.
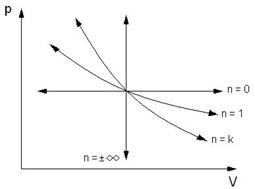
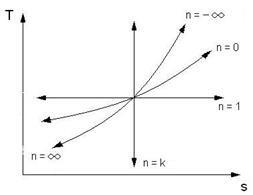
Все политропные процессы, расположенные над адиабатой идут с подводом теплоты. Политропные процессы, расположенные под адиабатой идут с отводом теплоты.
Политропные процессы, расположенные над изотермой идут с увеличением температуры, внутренней энергии и энтальпии. Политропные процессы, расположенные под изотермой идут с уменьшением температуры, внутренней энергии и энтальпии.
Политропные процессы, идущие влево от изохоры идут с отрицательной работой изменения объема газа. Политропные процессы, идущие вправо от изохоры идут с положительной работой изменения объема газа.
Политропные процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость.
Второй закон термодинамики
Дата добавления: 2015-04-03; просмотров: 2726;
