ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ. ГЕТЕРОГЕННЫЕ
ПРОЦЕССЫ В СИСТЕМЕ «ГАЗ–ТВЕРДОЕ ТЕЛО»
Гомогенные процессы протекают на микроуровне, т.е. на уровне взаимодействия молекул; процессы протекают с большими скоростями, и для интенсификации процессов используют изменение температуры, давления, концентрации реагирующих веществ и катализаторы. На практике, если возможно, гетерогенный процесс переводят в гомогенный. Примером такой реакции является получение диоксида серы: S+O2=SO2.
Расплав серы подается через форсунку в печь, реакция экзотермическая; при температуре 444 0С сера переходит в парообразное состояние и реакция становится газофазной. Газофазные реакции, как правило, протекают с образованием побочных продуктов, и здесь существенным фактором является концентрация реагирующих веществ.
Наиболее часто из гетерогенных реакций используется реакция, протекающая в системах «газ–твердое тело» (Г–Т), а также «газ–жидкость» (Г–Ж), «жидкость–жидкость (Ж–Ж), «твердое тело–твердое тело» (Т–Т), «жидкость–твердое тело» (Ж–Т). Особым классом гетерогенных процессов являются каталитические. Гетерогенный процесс в отличие от гомогенного протекает на границе раздела фаз, а при наличии инертного слоя или золы внутри твердой фазы химическая реакция будет одной из стадий ХТП.
Гетерогенный процесс включает пять стадий:
- внешнюю диффузию реагента через пограничный слой газа;
- внутреннюю диффузию реагента через слой золы или инерта;
- химическую реакцию;
- внутреннюю диффузию продуктов через слой золы или инерта;
- внешнюю диффузию продуктов через пограничный газовый слой.
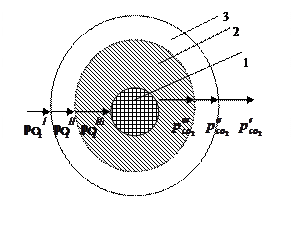
Классический пример гетерогенного процесса – горение угля (рисунок 5.1).
Каждая стадия протекает со своей скоростью, причем процесс, протекающий с минимальной скоростью, будет лимитировать суммарную скорость гетерогенного процесса.
Скорость ХТП выражается уравнением:
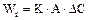 , (5.1)
, (5.1)
где К – коэффициент скорости гетерогенного процесса;
А – поверхность контакта фаз;
∆С – движущая сила процесса.
|
Наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
- химическая реакция;
- диффузия;
- одновременно химическая реакция и диффузия.
В первом случае скорость диффузии велика по сравнению со скоростью химической реакции; тогда говорят, что процесс протекает в кинетической области. Во втором случае скорость химической реакции значительно больше скорости диффузии – процесс протекает в диффузионной области (во внешне или внутренне диффузионной). В третьем случае скорость отдельных стадий соизмерима, тогда говорят, что процесс протекает в переходной (смешанной) области.
После установления лимитирующей стадии процесса принимаются меры, обеспечивающие повышение скорости этой стадии.
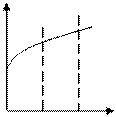
Известно, что при увеличении температуры на 10 0С скорость процесса возрастает в 2-4 раза, в то время как коэффициент диффузии возрастает всегда лишь на 5…10 %, следовательно, определяя скорость гетерогенного ХТП в зависимости от температуры, можно определить лимитирующую стадию (рисунок 5.2).
|
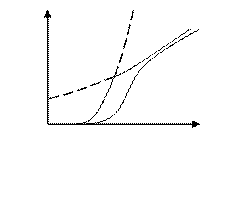
Лимитирующие стадии гетерогенного процесса можно определить, меняя температуру и скорость газового потока (рисунок 5.3).
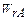
Кин. Перех. Диф. Диф. Перех. Кинетич.
Т 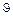
Рисунок 5.3 – Зависимость общей скорости процесса
от температуры и скорости потока
Меняя температуру и скорость газового потока, можно определить влияние внешней диффузии и скорости химической реакции на скорость гетерогенного процесса.
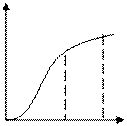
Влияние внутренней диффузии исследуется при изменении размера твердой фазы. Когда влияние температуры и скорости газового потока на скорость ХТП не существенно, меняют радиус частиц (рисунок 5.4).

Рисунок 5.4 – Зависимость общей скорости процесса
от радиуса частиц твердого реагента
Если 1/R<1/R1, то лимитирующей стадией является внутренняя диффузия.
Рассмотрим гетерогенную реакцию А(г)+В(тв)=R(тв) (частицы сферические) для трех случаев.
1. Процесс лимитируется внешней диффузией:
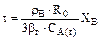 или
или 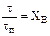 (5.2)
(5.2)
где 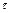 – продолжительность гетерогенного процесса, с;
– продолжительность гетерогенного процесса, с;
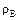 – плотность вещества В, кг/м3;
– плотность вещества В, кг/м3;
R0 – радиус твердой фазы с ядром и слоем золы, м;
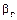 – коэффициент массоотдачи в газовой фазе, кг/[м2·с·(кг/м3)];
– коэффициент массоотдачи в газовой фазе, кг/[м2·с·(кг/м3)];
СА(г) – концентрация реагента А в газовой фазе, кг/м3;
ХВ – степень превращения реагента В;
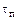 – время полного превращения частицы, с.
– время полного превращения частицы, с.
Зависимость степени превращения реагента В от отношения 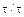 n является прямолинейной (рисунок 5.5).
n является прямолинейной (рисунок 5.5).
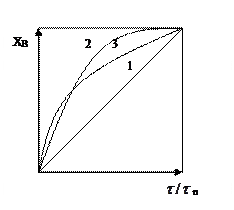
1 – процесс лимитируется внешней диффузией;
2 – процесс лимитируется внутренней диффузией;
3 – процесс лимитируется химической реакцией
Рисунок 5.5 – Зависимость степени превращения
от отношения τ/τn
Для интенсификации такого процесса (для уменьшения значения τ) необходимо:
- уменьшать размер твердой фазы (R0 стоит в числителе);
- увеличивать коэффициент массоотдачи (использовать перемешивание и увеличить скорость потока);
- увеличивать концентрацию СА(г) в газовой фазе.
2. Процесс лимитируется внутренней диффузией:
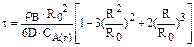 или
или 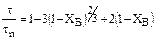 , (5.3)
, (5.3)
где D – коэффициент диффузии реагента А через слой золы, м2/с;
R – радиус ядра, м.
Относительная скорость такого процесса выше скорости процесса, протекающего в области внешней диффузии.
Для интенсификации такого процесса необходимо:
- создавать условия, ускоряющие диффузию, т.е. вводить в систему вещества, увеличивающие порозность инертного слоя или золы;
- увеличивать концентрацию СА(г) в газовой фазе.
3. Процесс лимитируется скоростью химической реакции:
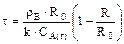 ,
, 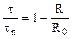 или
или 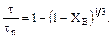
Если процесс лимитируется скоростью химической реакции, то кривая зависимость степени превращения от величины τ / τп похожа на кривую внутренней диффузии, разница мала и сопоставима с ошибками эксперимента.
Для интенсификации такого процесса необходимо:
- уменьшать размер частиц R0;
- увеличивать константу химической реакции путем повышения температуры;
- увеличивать концентрацию СА в газовой фазе.
Полученные зависимости ХВ=f( 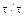 n) позволяют определить область протекания процесса. Для этого проводят ряд опытов, строят зависимости и сравнивают с теоретическими кривыми.
n) позволяют определить область протекания процесса. Для этого проводят ряд опытов, строят зависимости и сравнивают с теоретическими кривыми.
Дата добавления: 2015-06-17; просмотров: 3683;

 ,
,  ,
, 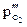 – парциальное давление кислорода;
– парциальное давление кислорода;
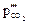 ,
, 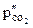 ,
, 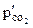 – парциальное давление углекислого газа
Рисунок 5.1 – Схема горения угля
– парциальное давление углекислого газа
Рисунок 5.1 – Схема горения угля