ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ В СИСТЕМАХ
«ГАЗ–ЖИДКОСТЬ» И «ЖИДКОСТЬ–ЖИДКОСТЬ»
Закономерности, отражающие процессы, протекающие в системах «газ–жидкость» (Г–Ж) и «жидкость–жидкость» (Ж–Ж), аналогичны, поэтому будем рассматривать только процессы в системах Г–Ж.
При соприкосновении газа, содержащего реагент А, с жидкостью, содержащей растворенный реагент В, газообразный реагент абсорбируется жидкостью и растворяется в ней. Рассмотрим условия, при которых реагенты вступают во взаимодействие в соответствии с уравнением А(г)+В(ж)→R(ж).
В зависимости от свойств реагента и жидкости профили концентраций реагента в пограничных слоях газа и жидкости могут быть различными.
Рассмотрим условия, когда взаимодействие между реагентами происходит в пограничном слое жидкости. В этом случае общее уравнение скорости процесса такое же, что и для системы Г–Т, и должно отражать две стадии взаимодействия реагентов – массообмен реагентов между фазами и собственно химическую реакцию. Соотношение скоростей этих стадий может изменяться в широких пределах. В одном, предельном случае химическая реакция протекает настолько быстро, что скорость диффузии веществ целиком лимитирует общую скорость процесса. В другом случае химическая реакция протекает настолько медленно, что газообразный реагент абсорбируется жидкостью и достаточно равномерно распределяется в ней, при этом общая скорость процесса целиком определяется скоростью химической реакции. Встречающиеся на практике процессы в системе Г–Ж в большинстве случаев занимают промежуточное состояние между двумя этими предельными случаями.
Если реакция протекает с большой скоростью и осуществляется в области пограничного слоя жидкости, процесс проходит через ряд стадий (рисунок 6.1).

I – поверхность раздела фаз; II – пограничный слой газа;
III – пограничный слой жидкости; IV – турбулентный поток газа;
V – турбулентный поток жидкости; VI – граница зоны реакции;
z – толщина пограничного слоя жидкости; zp – толщина слоя
жидкости, в котором протекает реакция
Рисунок 6.1 – Распределение концентрации реагентов
реакции А(г)+В(ж)→R(ж) в пограничных слоях газа и жидкости
Основные стадии:
- диффузия реагента А из турбулентного потока газа через пограничный слой газа II к поверхности раздела фаз I;
- диффузия реагента А от поверхности раздела фаз I в объем пограничного слоя жидкости III;
- диффузия активного компонента В из турбулентного потока жидкости через пограничный слой III в зону реакции VI;
- химическая реакция в пограничном слое жидкости;
- диффузия продукта R из пограничного слоя жидкости III в турбулентный поток жидкости V.
Общая скорость реакции, отнесенная к единице поверхности раздела фаз, в рассматриваемых случаях выражается уравнением:

 (6.1)
(6.1)
где 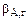 – коэффициент массоотдачи реагента А в газовой фазе;
– коэффициент массоотдачи реагента А в газовой фазе;
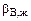 ,
,  – коэффициенты массоотдачи реагентов А и В в жидкой фазе.
– коэффициенты массоотдачи реагентов А и В в жидкой фазе.
Глубина зоны жидкой фазы, в которой протекает реакция, зависит от скорости химической реакции, концентрации реагентов А и В, а также от коэффициентов диффузии реагентов А и В в жидкости. Чем выше скорость реакции и выше концентрация реагента В, тем меньше зона реакции.
При очень большой скорости (мгновенной реакции) и высокой концентрации реагента В процесс завершается у поверхности раздела фаз. В этом случае сопротивление пограничного слоя газа становится определяющим для процесса в целом – процесс протекает во внешне-диффузионной области. Соответственно, упрощается уравнение (6.1):
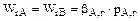 . (6.2)
. (6.2)
Для интенсификации такого процесса необходимо увеличивать парциальное давление компонента А в газовой фазе и увеличивать коэффициент массоотдачи в газовой фазе (что достигается увеличением скорости газового потока и его турбулизацией).
По мере уменьшения скорости химической реакции могут существовать различные режимы. Например, если скорость химической реакции и скорость диффузии в газовой фазе соизмеримы, процесс протекает в переходной области.
Если скорость реакции мала, зона реакции охватывает весь пограничный слой жидкости III и попадает в турбулентный поток жидкости V. В этом случае скорость процесса зависит как от скорости диффузии в жидкой фазе, так и от скорости химической реакции. Для повышения скорости такого процесса необходимо увеличить скорость диффузии реагента А в пограничном слое газа к поверхности раздела фаз, а также увеличить скорость химической реакции (рисунок 6.2).
|
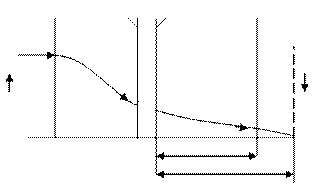
Рисунок 6.2 – Распределение концентрации реагентов
реакции А(г)+В(ж)→R(ж) в пограничных слоях газа и жидкости
при малой скорости химической реакции
|
90 % химических реакций являются каталитическими. Под катализом понимают изменение скорости при применении катализатора.
Катализ может быть положительным и отрицательным.
Если катализ отрицательный, то вещества называют ингибиторами.
Катализатор применяют в трех агрегатных состояниях, в основном применяют твердый катализатор (производство серной кислоты, синтез аммиака, производство азотной кислоты и т.д.); жидкие катализаторы применяются при осуществлении ХТП в жидкой среде; применение газообразных катализаторов очень редко.
В характеристике реакции всегда указывается каталитическая она или нет. Применение катализатора, кроме очевидных плюсов, с технологической точки зрения имеет следующие недостатки:
- выделение катализатора, если реакция гомогенно-каталитическая;
- применение очистки продуктов от каталитической пыли.
Существует большое количество теорий, объясняющих действие катализатора. Наибольшее распространение получила теория промежуточных состояний, согласно которой химическая реакция между реагентами заменяется на две или более реакции реагентов с катализаторами, когда образуются непрочные химические соединения между реагентами и катализаторами. Ускоряющее действие катализатора заключается в понижении энергии активации химической реакции.
Для характеристики каталитического процесса используют следующие показатели:
- активность. Это отношение константы химической реакции с использованием катализатора к константе химической реакции без катализатора А= kK/k;
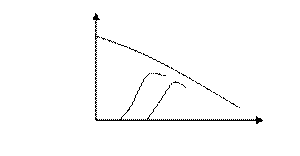
- температуру зажигания катализатора. Это та минимальная температура реакционной смеси, при которой процесс протекает с приемлемой для промышленности скоростью. Чем выше активность катализатора, тем меньше температура зажигания. Чем меньше температура зажигания, тем меньше расходы на нагрев реакционной смеси и тем больше температурный диапазон для регулировки температуры. Это особенно важно при протекании обратимых экзотермических реакций (рисунок 7.1);
- селективность. Это избирательность, следовательно, катализатор должен ускорять целевую реакцию, не влияя на побочные взаимодействия;
- отравляемость катализатора (обратимая и необратимая). Если из контактного аппарата убрать каталитические яды, и активность катализатора восстановится, то имеет место обратимое отравление.
Если каталитические яды из контактного аппарата были удалены, а активность катализатора не восстановилась, то катализатор был необратимо отравлен. Отравление катализатора может быть полным и частичным;
- τК – время контактирования;
- S – объемную скорость.
|
Для уменьшения стоимости катализатора и увеличения поверхности контакта фаз используется контактная масса.
Контактная масса состоит: из трегера (носителя) – твердого пористого вещества, на которое тем или иным методом нанесены катализатор и активатор; активаторов – веществ, ускоряющих действие самого катализатора.
Элементарные стадии гетерогенного катализа представлены на рисунке 7.2.
|
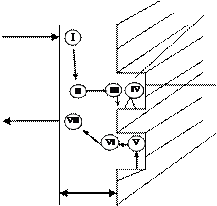
1 – газовый поток; 2 – пограничный слой; 3 – внешняя поверхность
катализатора; 4 – поры катализатора; 5 – внутренняя поверхность пор катализатора
I – внешняя диффузия реагентов из ядра газового потока к
поверхности раздела фаз; II – внутренняя диффузия реагентов в порах катализатора; III – активированная адсорбция с образованием
поверхностных не прочных химических соединений – активированных комплексов; IV – перегруппировка атомов с образованием
активированных комплексов продукт–катализатор; V – десорбция
продукта с поверхности; VI – внутренняя диффузия продукта в порах катализатора; VII – внешняя диффузия продукта в ядро газовой
поверхности
Рисунок 7.2 – Элементарные стадии гетерогенного катализа
По сравнению с гетерогенным процессом появились стадии III, IV, V.
Катализаторы и контактная масса применяются в виде сеток, гранул, таблеток и колец.
Подготовка контактной массы включает следующие стадии:
- осаждение гидроокисей и карбонатов на носителе с последующим формованием и прокаливанием;
- пропитку носителя растворами катализатора и активатора;
- сплавление веществ;
- совместное прессование всех компонентов с вяжущими веществами.
Дата добавления: 2015-06-17; просмотров: 1819;
