Важнейшие алхимические знаки 7 страница
Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Все упомянутые модели – Томсона-Томсона, Перрена-Нагаоки и Ленарда являлись сугубо гипотетическими и исключительно качественными.
| Первые модели строения атома: | |
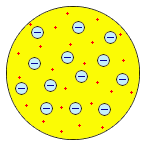 У. Томсон, 1902 г. У. Томсон, 1902 г.
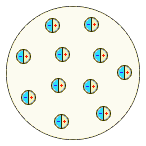
|  Дж. Дж. Томсон, 1904 г. Дж. Дж. Томсон, 1904 г.
|
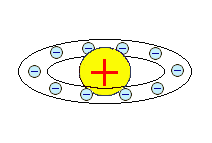
 Ф. Ленард, 1904 г. Ф. Ленард, 1904 г.
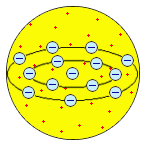
|  Х. Нагаока, 1904 г. Х. Нагаока, 1904 г.
|
В 1906-1909 гг. Ганс Гейгер, Эрнст Марсден и Эрнест Резерфорд, пытаясь найти экспериментальные подтверждения модели Томсона, провели свои знаменитые опыты по рассеиванию α-частиц на золотой фольге. Они использовали α-частицы вместо электронов, т.к. благодаря своей большей массе (в 7350 раз больше массы электрона) α-частицы не претерпевают заметного отклонения при столкновении с электронами, что позволяет регистрировать только столкновения с положительной частью атома. В качестве источника α-частиц ими был взят радий, а частицы, претерпевавшие рассеяние в тонкой золотой фольге, регистрировались по сцинтилляционным вспышкам на экране из сульфида цинка, находящемся в затемненной комнате.
Результат опытов оказался совершенно противоположным ожидаемому. Большинство α-частиц проходило через золотую фольгу по прямым или почти прямым траекториям, но в то же время некоторые α-частицы отклонялись на очень большие углы, что свидетельствовало о наличии в атоме чрезвычайно плотного положительно заряженного образования. Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым. Тем не менее, модель Резерфорда послужила основой для создания принципиально новой теории, которую разработал в 1913 г. датский физик Нильс Хенрик Давид Бор.
Модель Бора опиралась на квантовую гипотезу, которую выдвинул в 1900 г. немецкий физик Макс Карл Эрнст Людвиг Планк. Планк постулировал, что вещество может испускать энергию излучения только конечными порциями, пропорциональными частоте этого излучения. Применив квантовую гипотезу для объяснения фотоэффекта, Альберт Эйнштейн в 1905 г. предложил фотонную теорию света.
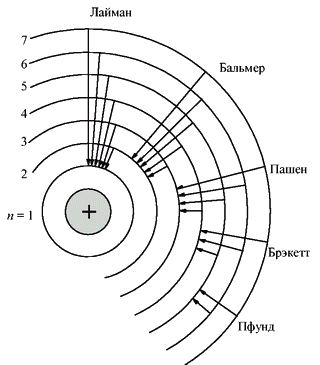
Ещё одной предпосылкой для боровской модели атома стали серии спектральных линий водорода, которые обнаружили в 1885 г. швейцарский ученый Иоганн Якоб Бальмер, в 1906 г. американский физик Теодор Лайман и в 1909 г. немецкий физик Фридрих Пашен. Эти серии (в видимой, ультрафиолетовой и инфракрасной областях спектра) подчинялись очень простой закономерности: частоты были пропорциональны разности обратных квадратов целых чисел.
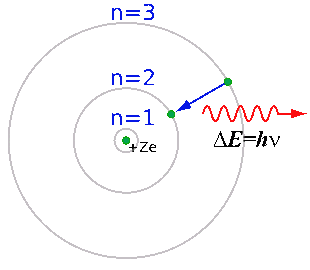
Бор объяснил устойчивость планетарной модели атома и одновременно эти спектральные данные с позиций квантовой теории, сформулировав ряд постулатов, накладывающих на модель атома квантовые ограничения. Согласно постулатам Бора, электрон может вращаться вокруг ядра лишь по некоторым определённым дозволенным ("стационарным") орбитам, находясь на которых, он не излучает энергию. Ближайшая к ядру орбита соответствует "нормальному" (наиболее устойчивому) состоянию атома. При сообщении атому кванта энергии электрон переходит на более удалённую орбиту. Обратный переход из "возбуждённого" в "нормальное" состояние сопровождается испусканием кванта излучения.
| 
|
Как показал расчёт на основании спектральных данных, радиусы электронных орбит относятся как 12 : 22 : 32 : … : n2. Иначе говоря, момент количества движения вращающегося электрона пропорционален целочисленному главному квантовому числу (номеру орбиты).
Максимально возможное число электронов на каждом уровне равно удвоенному квадрату главного квантового числа; это число оказалось равным количеству элементов в периодах периодической таблицы. Модель Бора, таким образом, выявила несомненную связь периодичности свойств элементов со строением электронных оболочек атомов.
Для атома водорода расчёты спектров на основе модели Бора дали хорошее согласие с экспериментом, но для других элементов получалось существенное расхождение с опытными данными. В 1916 г. немецкий физик Арнольд Иоганн Вильгельм Зоммерфельд уточнил модель Бора. Зоммерфельд высказал предположение, что кроме круговых, электрон может двигаться и по эллиптическим орбитам. При этом почти одинаковому уровню энергии соответствует число типов орбит, равное главному квантовому числу. Зоммерфельд дополнил модель побочным (орбитальным) квантовым числом (определяющим форму эллипсов) и зависимостью массы электрона от скорости. Основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями (в классическую картину вводились квантовые ограничения), Нильс Бор в 1921 г. заложил основы формальной теории периодической системы. Причина периодичности свойств элементов, по мнению Бора, заключалась в периодическом повторении строения внешнего электронного уровня атома.
В 1925 г. Вольфганг Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя: в данном квантовом состоянии может находиться только один электрон. Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное квантовое число n, азимутальное квантовое число l и два магнитных числа m1 и m2. Вскоре после выхода работы Паули молодые физики Джордж Юджин Уленбек и Сэмюэл Абрахам Гаудсмит ввели в атомную физику представление о спине электрона. Американский физик Артур Холли Комптон, основываясь на атомных спектрах высокого разрешения, ещё в 1921 г. высказывал предположение о квантованном вращении электрона, а в следующем году Отто Штерн и Вальтер Герлах экспериментально наблюдали разделение пучка атомов серебра в магнитном поле на две части, соответствующие ориентации электронных спинов.
В 1927 г. немецкий физик Фридрих Хунд сформулировал эмпирические правила заполнения электронных оболочек. С применением запрета Паули и принципа насыщения уровней к 1927 г. была в целом построена электронная структура всех известных к тому времени 92 элементов. Создание учения о строении электронных оболочек атомов позволило создать формальную физическую теорию периодической системы, объяснившую причины периодичности свойств элементов и их соединений, а также создать первые теории химической связи.
Представления о природе химической связи
На протяжении всего XIX века химия, основанная на атомно-молекулярной теории, не могла дать никаких объяснений природе связи между атомами. Понятие валентности, при всей плодотворности его применения, оставалось сугубо эмпирическим. Лишь после открытия делимости атома и установления природы электрона как составной части атома возникли реальные предпосылки для разработки первых теорий химической связи.
Немецкие учёные Рихард Вильгельм Генрих Абегг и Гвидо Бодлендер в 1899 г. высказали идею о сродстве атомов к электрону – способности атомов присоединять электрон: "Вследствие того, что для существования неорганических соединений сродство атомов или отдельных групп к электрическому заряду оказывается гораздо более важным, нежели сродство их друг к другу, кажется вполне целесообразным принять за основу систематики неорганических веществ именно это сродство элементов и радикалов к электричеству...".
На основе этих представлений Абегг в 1904 г. разработал теорию электровалентности. Валентностью, по мнению Абегга, обладают ионы, и величина валентности равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями – положительной и отрицательной, сумма которых равна восьми. Одна из них, производящая более сильное действие, нормальная, другая – контрвалентность. Для семи групп периодической системы Абегг приводил следующие значения нормальных и контрвалентностей:
| Группа Нормальная валентность Контрвалентность | I +1 –7 | II +2 –6 | III +3 –5 | IV +4 –4 | V –3 +5 | VI –2 +6 | VII –1 +7 |
Следует отметить, что формулы высших оксидов и водородных соединений, приводимые Менделеевым в своей таблице, аналогичны построениям Абегга.
Все дальнейшие попытки объяснения природы валентных сил находились в тесной связи с представлениями о строении атома. Дж. Дж. Томсон в своей модели строения атома указывал на участие электронов в образовании связи между атомами. В 1908 г. Уильям Рамзай высказал идею о связи атомов посредством общего электрона. Нильс Бор в 1913 г. предложил динамическую модель молекулы, в которой химическая связь возникает за счёт электронов, находящихся на общей для двух атомов орбите; плоскость этой орбиты перпендикулярна линии, соединяющей ядра. Иоганнес Штарк в 1915 г. ввёл в теорию понятие о валентных электронах: согласно Штарку, валентность атома не связана с общим числом электронов в атоме, а определяется только числом поверхностных электронов. Представления Штарка о валентных электронах и модель атома Резерфорда-Бора легли в основу новых теорий химической связи.
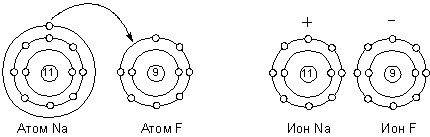
Представления об электровалентности или полярной валентности получили развитие в работах немецкого физика Вальтера Косселя. В 1916 г. он разработал теорию гетерополярной (ионной) связи, основанную на модели атома Бора и представлении об особой стабильности двух- или восьмиэлектронных оболочек инертных газов. Реакционная способность атома, по Косселю, определяется его стремлением приобрести такую электронную конфигурацию. Учитывая тот факт, что большинство неорганических соединений полярно и способно диссоциировать на ионы, он предположил, что природа валентных сил заключается в электростатическом притяжении ионов, образующихся за счёт отдачи одним атомов одного или нескольких электронов другому. Ниже приведена схема образования молекулы фторида натрия по Косселю:
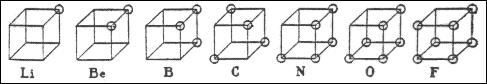
В 1916 г. американский химик Джилберт Ньютон Льюис предложил теорию кубического атома, основанную на сходных предпосылках. Согласно Льюису, химическая инертность элементов нулевой группы периодической системы объясняется тем, что группы из двух или восьми электронов являются очень устойчивыми. По мнению Льюиса, атом гелия имеет два электрона; атом неона – два электрона, расположенных внутри куба, образованного восемью электронами. В аргоне ещё восемь электронов расположены в вершинах куба, внешнего по отношению к кубу неона. Атомы других элементам стремятся к приобретению или отдаче электронов, чтобы приобрести электронную конфигурацию инертного газа. Образование связи между одинаковыми атомами Льюис объяснил возможностью обобществления валентных электронов. Льюис предложил также способ изображения связей, в котором каждый валентный электрон обозначается точкой (формулы Льюиса).
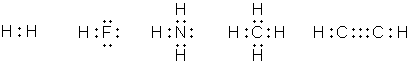
Аналогичные взгляды высказал Ирвинг Ленгмюр, который, однако, отбросил идею о стационарном кубическом расположении внешних электронов в атоме. Ленгмюр предположил существование трёх типов валентности: положительной, отрицательной и ковалентности. Положительная и отрицательная валентности определяются числом электронов, которые атом способен соответственно отдать или принять. Ковалентность определяется числом электронных пар, которыми атом может владеть совместно с другими атомами. В начале 1920-х гг. английский химик Невилл Винсент Сиджвик распространил понятие ковалентности на неорганические и координационные соединения, постулировав существование похожего типа связи, в котором оба электрона связывающей электронной пары изначально принадлежали одному из соединяющихся атомов (семиполярная или донорно-акцепторная связь).
В целом можно отметить, что теории Косселя и Льюиса-Ленгмюра позволили весьма удачно объяснить, как образуются химические связи между атомами в неорганических и органических соединениях. Основанные на "полуклассической" модели атома Бора-Зоммерфельда, теории ионной и ковалентной связи удачно сочетали простоту и наглядность с новейшими современными представлениями о строении атома.
Опираясь на теории Косселя и Льюиса-Ленгмюра, в 1923 г. датский химик Йоханнес Николаус Брёнстед и англичанин Томас Мартин Лаури разработали протонную теории кислот и оснований, а Джилберт Льюис расширил представления о кислотах и основаниях, предложив электронную теорию, согласно которой кислота кислота является акцептором, а основание – донором электронных пар.
Однако многие вопросы по-прежнему оставались без ответов. Теория Льюиса-Ленгмюра не могла объяснить причины связующего действия электронной пары; помимо этого, имелось множество отклонений от правила октета. Окончательное установление природы связи между атомами оказалось возможным лишь на основании принципиально новых – квантовомеханических – представлений.
Квантовая химия
Для того, чтобы объяснить устойчивость атома, Нильс Бор соединил в своей модели классические и квантовые представления о движении электрона. Однако искусственность такого соединения была очевидна с самого начала. Развитие квантовой теории привело к изменению классических представлений о структуре материи, движении, причинности, пространстве, времени и т.д., что способствовало коренному преобразованию картины мира. В конце 20-х – начале 30-х годов XX века на основе квантовой теории сформировались принципиально новые теории строения атома и образования химической связи.
После создания Альбертом Эйнштейном фотонной теории света (1905) и выведения им статистических законов электронных переходов в атоме (1917) в физике обострилась проблема "волна – частица". Если в XVIII-XIX веках имелись расхождения между различными учеными, которые для объяснения одних и тех же явлений в оптике привлекали либо волновую, либо корпускулярную теорию, то теперь противоречие приобрело принципиальный характер: одни явления (дифракция) интерпретировались с волновых позиций, а другие (фотоэффект) – с корпускулярных.
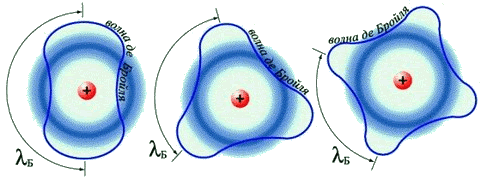
|
| Волны Де Бройля для электрона с n = 2, 3, 4 |
Разрешение этого противоречия предложил в 1924 г. французский физик Луи Виктор Пьер Раймон де Бройль, приписавший волновые свойства частице. Распространив идею о двойственной природе света на вещество, де Бройль предположил наличие у материальных частиц волновых свойств, однозначно связанных с массой и энергией. Он показал, что движению электрона может соответствовать некоторая волна материи, так же как движению светового кванта соответствует световая волна. Де Бройль предложил объяснить квантовые условия теории Бора с помощью представления о волнах материи. Волна, движущаяся вокруг ядра атома, по геометрическим соображениям может быть только стационарной волной; длина орбиты должна быть кратной целому числу длин волн. Гипотеза де Бройля о наличии у электронов волновых свойств была подтверждена обнаруженным в 1927 г. явлением дифракции электронов: оказалось, что пучок электронов дает дифракционную картину (позже будет обнаружена дифракция атомов и молекул).
Исходя из идеи де Бройля о волнах материи, немецкий физик Эрвин Шрёдингер в 1926 г. вывел основное уравнение т.н. волновой механики, содержащее волновую функцию и позволяющее определить возможные состояния квантовой системы и их изменение во времени. Шредингер дал общее правило преобразования классических уравнений в волновые. В рамках волновой механики атом можно было представить в виде ядра, окруженного стационарной волной материи. Волновая функция определяла плотность вероятности нахождения электрона в данной точке.
В том же 1926 г. другой немецкий физик Вернер Гейзенберг разработал свой вариант квантовой теории атома в виде матричной механики, отталкиваясь при этом от сформулированного Бором принципа соответствия. Согласно принципу соответствия, законы квантовой физики должны переходить в классические законы, когда квантовая дискретность стремится к нулю при увеличении квантового числа). В более общем виде принцип соответствия можно сформулировать следующим образом: новая теория, которая претендует на более широкую область применимости по сравнению со старой, должна включать в себя последнюю как частный случай. Квантовая механика Гейзенберга позволяла объяснить существование стационарных квантованных энергетических состояний и рассчитать энергетические уровни различных систем.
Результаты, к которым приводили методы, используемые в волновой механике Шрёдингера и матричной механике Гейзенберга, оказались одинаковыми, поэтому обе концепции и входят в единую квантовую теорию как эквивалентные.
Однако изначально волновая и матричная механики имели принципиальные различия в подходах. У Шрёдингера частица выступала как чисто волновое образование, т.е. частица есть место волны, в котором сосредоточена наибольшая энергия волны. Интерпретация Шрёдингера представляла собой, по сути, попытку создать более или менее наглядные модели в духе классической физики. Гейзенберг же сформулировал принцип неопределенности, в соответствии с которым точность определения координаты частицы обратно пропорциональна точности определения её скорости. Принцип неопределенности указывает на то, что частицы могут вести себя как волны – они как бы "размазаны" в пространстве, поэтому можно говорить не об их точных координатах, а лишь о вероятности их обнаружения в определенном пространстве. Таким образом, квантовая механика фиксирует корпускулярно-волновой дуализм – в одних случаях удобнее частицы считать волнами, в других, наоборот, волны частицами.
С принципом неопределённости поначалу соглашались далеко не все физики; его всеобщему признанию предшествовала довольно длительная дискуссия. Осуществлённая Гейзенбергом и развитая Бором интерпретация квантовой теории получила название копенгагенской. В рамках данной интерпретации основным положением квантовой теории выступает принцип дополнительности, означающий требование применять для получения целостной картины изучаемого объекта взаимоисключающие классы понятий, приборов и исследовательских процедур, которые используются в своих специфических условиях и взаимно дополняют друг друга. Принцип дополнительности, таким образом, позволил дополнить классические теории квантовыми, а не противопоставить их друг другу.
Вскоре после того, как Гейзенберг и Шрёдингер разработали квантовую механику, Поль Адриен Морис Дирак предложил более общую теорию, в которой элементы специальной теории относительности Эйнштейна сочетались с волновым уравнением. Уравнение Дирака применимо к частицам, движущимся с произвольными скоростями. Спин и магнитные свойства электрона следовали из теории Дирака без каких бы то ни было дополнительных предположений. Кроме того, теория Дирака предсказывала существование античастиц, таких, как позитрон и антипротон, – двойников частиц с противоположными по знак электрическими зарядами.
Квантово-механический подход к строению атома привёл к созданию принципиально новых представлений о природе химической связи. Уже в 1927 г. Вальтер Гейтлер и Фриц Лондон начали разрабатывать квантовомеханическую теорию химической связи и выполнили приближённый расчёт молекулы водорода. Распространение метода Гейтлера-Лондона на многоатомные молекулы привело к созданию метода валентных связей, который разработали в 1928-1931 гг. Лайнус Карл Полинг и Джон Кларк Слэтер. Основная идея этого метода заключается в предположении, что атомные орбитали сохраняют при образовании молекулы известную индивидуальность. В 1928 г. Полинг предложил теорию резонанса и идею гибридизации атомных орбиталей, в 1932 г. – новое количественное понятие электроотрицательности и шкалу электроотрицательностей, выразил зависимость между электротрицательностью и энергией химической связи.
Фридрих Хунд, Роберт Сандерсон Малликен и Джон Эдвард Леннард-Джонс в 1929 г. начали разработку метода молекулярных орбиталей. В основу ММО заложено представление о полной потере индивидуальности атомов, соединившихся в молекулу. Молекула, таким образом, состоит не из атомов, а представляет собой новую систему, образованную несколькими атомными ядрами и движущимися в их поле электронами. Фридрих Хунд предложил также современную классификацию химических связей; в 1931 г. он пришёл к выводу о существовании двух основных типов химических связей – простой, или σ-связи, и π-связи. В том же году немецкий физик Эрих Хюккель распространил метод МО на органические соединения, сформулировав в правило ароматической стабильности (4n+2), устанавливающее принадлежность вещества к ароматическому ряду.
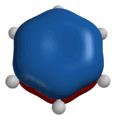  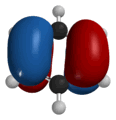 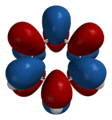
|
| Форма некоторых молекулярных орбиталей бензола |
Таким образом, в квантовой химии сразу выделились два различных подхода к пониманию химической связи: метод молекулярных орбиталей и метод валентных связей. Сравнивая эти два метода, нетрудно заметить известные аналогии с теориями структурной химии XIX века – различия этих методов напоминают различия между новой теорией типов и теорией валентности. ММО, как некогда новая теория типов, рассматривает молекулу как принципиально новое, единое образование; МВС, подобно теории валентности, в значительной степени представляет собой аддитивный подход. Поскольку квантово-механическая модель атома оказалась куда менее наглядной, чем классическая, метод ВС как представление, которое, сохранив наглядность, не слишком противоречило истине, получил (особенно поначалу) более широкое распространение. Однако, несмотря на различия в подходах, оба метода приводят к практически одинаковым результатам.
Благодаря квантовой механике к 30-м годам XX века в основном был выяснен способ образования связи между атомами (что, кстати говоря, являлось труднейшим вопросом атомизма, начиная от Левкиппа и Демокрита). Кроме того, в рамках квантово-механического подхода получило корректную физическую интерпретацию менделеевское учение о периодичности.
ЗАКЛЮЧЕНИЕ
К середине 30-х годов XX века химическая теория приобретает вполне современный вид. Хотя основные концепции химии в дальнейшем стремительно развивались, принципиальных изменений в теории больше не происходило.
Следует отметить, что всё сказанное в предыдущей главе об истории установления строения атома и природы связи между атомами является историей не только и не столько химии, сколько физики и естествознания вообще. Установление делимости атома, квантовой природы излучения, создание теории относительности и квантовой механики представляли собой революционный переворот в понимании окружающих человека физических явлений. Этот переворот коснулся прежде всего микро- и мегамира, что к химии в классическом смысле, казалось бы, не имеет прямого отношения. Однако в этом и заключается одна из особенностей химии XX века: для понимания причин, которыми обусловлены фундаментальные химические законы, потребовалось выйти за пределы предмета химии. Ныне теоретическая химия в значительной степени представляет собой физику (прежде всего термодинамику и атомную физику), "адаптированную" для решения химических задач. В значительной степени именно достижения физики сделали возможными огромные успехи теоретической и прикладной химии в XX столетии.
Изложение содержательной части современной химии в кратком историческом очерке вряд ли возможно вследствие колоссального объёма информации. Быть может, имело бы смысл привести обзор основных этапов, однако этот обзор ни в коей мере не мог бы претендовать на полноту. Химия в XX веке чрезвычайно усложнилась и расширилась по сравнению с классическим периодом. Объём химических знаний стал настолько велик, что составление краткого, в несколько страниц, очерка новейшей истории химии представляет собой сложнейшую задачу, взяться за которую автор настоящей работы не считает для себя возможным.
Тем не менее, необходимо выделить основные черты современной химии, отличающие её от классической химии второй половины XIX века.
Прежде всего, создание надёжного теоретического фундамента привело к значительному росту возможностей прогнозирования свойств вещества. Современная химия немыслима без широкого использования физико-математического аппарата и разнообразных расчётных методов. Прогностические возможности химии распространяются не только на свойства вещества, основные количественные характеристики которых зачастую могут быть рассчитаны до опыта, но и на условия синтеза этого вещества.
Еще одной особенностью химии в ХХ веке стало появление большого числа новых аналитических методов, прежде всего физических и физико-химических. Широкое распространение получили рентгеновская, электронная и инфракрасная спектроскопия, магнетохимия и масс-спектрометрия, спектроскопия ЭПР (электронного парамагнитного резонанса) и ЯМР (ядерного магнитного резонанса), рентгеноструктурный анализ и т.п.; список используемых методов чрезвычайно обширен. Новые данные, полученные с помощью физико-химических методов, заставили пересмотреть целый ряд фундаментальных понятий и представлений химии. Сегодня ни одно химическое исследование не обходится без привлечения физических методов, которые позволяют определять состав исследуемых объектов, устанавливать мельчайшие детали строения молекул, отслеживать протекание сложнейших химических процессов.
Для современной химии также стало очень характерным всё более тесное взаимодействие с другими естественными науками. Физическая и биологическая химия стали важнейшими разделами химии наряду с классическими – неорганической, органической и аналитической. Пожалуй, именно биохимия со второй половины ХХ столетия занимает лидирующее положение в естествознании. Характер взаимодействия естественных наук в XX веке В. И. Вернадский определил следующим образом: «…Рост научного знания быстро стирает грани между отдельными науками. Мы всё больше специализируемся не по наукам, а по проблемам. Это позволяет, с одной стороны, чрезвычайно углубляться в изучаемое явление, а с другой – расширить охват его со всех точек зрения».
Одновременно с процессом интеграции естественных наук в ХХ столетии интенсивно протекал и процесс дифференциации самой химии. Хотя границы между вновь выделяющимися разделами химии достаточно условны, коллоидная и координационная химия, кристаллохимия и электрохимия, химия высокомолекулярных соединений и некоторые другие разделы приобретают черты самостоятельных наук.
Все перечисленные особенности современной химии в совокупности способствовали значительному увеличению скорости накопления химических знаний. Объём знаний настолько вырос, что изобилие информации стало одной из серьёзных проблем сегодняшней науки.
Неизбежным следствием совершенствования химической теории явились новые успехи практической химии. Из выдающихся достижений химии XX века достаточно упомянуть хотя бы такие, как каталитический синтез аммиака, получение синтетических антибиотиков и полимерных материалов. Успехи химиков в деле получения вещества с желаемыми свойствами в числе прочих достижений прикладной науки к концу XX столетия привели к коренным преобразованиям в жизни человечества. Химики нашли лекарства от неизлечимых ранее болезней, получили вещества и материалы, использование которых существенно улучшило условия жизни людей. В значительной степени благодаря развитию прикладной химии средняя продолжительность жизни человека за двадцатое столетие выросла практически вдвое.
Впрочем, современная химия дала в руки людей также и эффективные средства сокращения продолжительности человеческой жизни. Достижения науки далеко не всегда используются людьми в благих целях, не всегда результаты практического использования научных открытий оказываются в точности такими, как ожидалось. Всякий успех в деле покорения природы неизбежно влечёт за собой, наряду с выгодами, ещё и появление новых проблем – экологических, этических и т.п., решение которых опять-таки является не в последнюю очередь задачей науки.
Говоря об успехах практического приложения достижений науки, следует подчеркнуть, что история естествознания вообще и химии в частности постоянно подтверждает особую ценность фундаментальных исследований – "знания ради знания". Исторический опыт наглядно свидетельствует, что почти всякое значительное научное открытие в момент своего совершения лишено практической ценности. Однако именно на том, что изучено фундаментальной наукой десятилетия назад, основываются сегодняшние успехи науки прикладной.
Ещё одним важнейшим результатом достижений фундаментальной науки является создание и постоянное совершенствование научной картины мира. Поскольку наши представления о Вселенной создаются индуктивным путём, от частного к общему, научная картина мира непрерывно уточняется и в принципе не может быть окончательно завершённой. Свой вклад в её совершенствование предстоит внести и тем, кому адресован настоящий очерк – сегодняшним студентам-химикам.
Дата добавления: 2015-04-15; просмотров: 1423;
