Важнейшие алхимические знаки 3 страница
Открытый Рихтером закон подтвердил убеждения многих химиков в том, что химические соединения взаимодействуют не в произвольных, а в строго определённых количественных соотношениях. Однако за этим последовала длительная дискуссия о том, присуща ли такая определённость всем без исключения химическим процессам. Основным предметом дискуссии стал вопрос о том, является ли постоянным соотношение элементов в соединении, состоящем из двух или более элементов, или же состав зависит от способа получения вещества. Клод Луи Бертолле, основываясь на предложенной им теории химического сродства*, обусловленного силами притяжения и зависящего от плотности вещества и его количества, отстаивал предположение о том, что элементный состав вещества может изменяться в некоторых пределах в зависимости от условий, в которых оно было получено.
В полемику с Бертолле отважился вступить французский химик Жозеф Луи Пруст. С помощью тщательных анализов в 1799-1806 годах Пруст установил, что отношение количеств элементов в составе соединения всегда постоянно. Выводы Бертолле, как показал Пруст, были ошибочны из-за неточности анализов и недостаточной чистоты исходных веществ. Дискуссия завершилась блестящей победой Пруста. Закон постоянства состава (постоянных отношений) в итоге не просто был признан большинством химиков, но стал одним из главных химических законов. Однако вопрос о причинах постоянства состава оставался открытым, поскольку из чисто аналитической концепции химического элемента это никоим образом не следует. Разрешить существующие сомнения могло лишь предположение о дискретности материи, однако атомистические взгляды по-прежнему не имели никаких экспериментальных доказательств.
*Термин избирательное сродство предложил в 70-е годы XVIII века Торберн Улаф Бергман для объяснения реакционной способности веществ; он же составил первые таблицы сродства.
Атомистическая теория Дальтона
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений.
Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. Основываясь на законе кратных отношений, открытом в 1803 году, и законе постоянства состава, Дальтон разработал свою атомно-молекулярную теорию, изложенную в вышедшем в 1808 году труде "Новая система химической философии".
Основные положения теории Дальтона состояли в следующем:
1. Все вещества состоят из большого числа атомов (простых или сложных).
2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
4. Важнейшим свойством атомов является атомный вес.
Уже в 1803 года в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений; в качестве точки отсчёта Дальтон выбрал атомный вес водорода, принятый равным единице. Для обозначения атомов элементов Дальтон использовал символы в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения атомных весов.
| Простые атомы | Сложные атомы | ||||

| Водород | 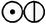
| Аммиак | ||

| Кислород | 5.66 | 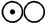
| Вода | 6.66 |

| Азот | 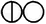
| Монооксид азота | 9.66 | |

| Углерод | 4.5 | 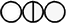
| Диоксид азота | 13.66 |

| Сера |
Таблица Дальтона стала первым шагом на долгом пути, который предстояло пройти химии для того, чтобы величины атомных масс приняли привычные для нас значения. Разрешение проблемы определения атомных весов, потребовавшее усилий многих выдающихся учёных, заняло более пятидесяти лет! И даже после того, как проблема была в основном решена, точное определение атомным масс оставалось настолько важной задачей, что в 1914 году американский учёный Теодор Ричардс был удостоен Нобелевской премии за уточнение атомных масс некоторых элементов.
Проблема определения атомных масс
Главное затруднение при определении атомной массы состоит в том, что необходимо установить число атомов каждого элемента, входящее в состав соединения. Дальтон был вынужден сделать допущение о том, что атомы разных элементов при образовании сложных атомов соединяются по "принципу максимальной простоты". Суть принципа заключается в следующем: если имеется лишь одно бинарное соединение двух элементов, то его молекула (сложный атом) образована одним атомом одного элемента и одним атомом другого (сложный атом является двойным в терминологии Дальтона). Тройные и более сложные атомы образуются лишь в том случае, когда имеются несколько соединений, образованных двумя элементами. Отсюда Дальтон предполагал, что молекула воды состоит из одного атома кислорода и одного атома водорода. Результатом являлось заниженное значение атомного веса кислорода, что вело, в свою очередь, к неправильному определению атомных весов металлов на основании состава оксидов. Принцип наибольшей простоты (подкреплённый авторитетом Дальтона как создателя атомно-молекулярной теории) сыграл в дальнейшем определённую негативную роль при решении проблемы атомных весов. Однако в целом атомистическая теория Дальтона составила основу всего дальнейшего развития естествознания.
Решению проблемы атомных весов способствовало открытие ещё целого ряда стехиометрических законов.
Закон объёмных отношений (закон соединения газов) открыл французский химик Жозеф Луи Гей-Люссак. Гей-Люссак в 1808 году показал, что газы всегда соединяются в простых объёмных соотношениях.
Амедео Авогадро ди Кваренья выдвинул в 1811 году предположение, получившее название гипотезы (закона) Авогадро: "Равные объёмы газов при одинаковых давлении и температуре содержат одинаковое число молекул, так что плотность газов служит мерой массы их молекул и отношение объёмов при соединении суть не что иное, как отношение между числом молекул, соединяющихся между собой при образовании сложной молекулы". При выводе своего закона Авогадро использовал закон Гей-Люссака и результаты исследования электролиза воды, которое провели в 1800 году два английских химика – Уильям Николсон и Энтони Карлайл. Николсон и Карлайл обнаружили, что объёмы выделяющихся при электролизе водорода и кислорода относятся как 2:1. Следствием из гипотезы Авогадро являлось предположение о том, что газообразные водород, кислород, азот и хлор состоят из двухатомных молекул; однако этот вывод вызвал резкие возражения. Предположение о том, что корпускулы элементарных субстанций являются сложными, казалось химикам противоречащим здравому смыслу. Молекулярная гипотеза Авогадро не была принята большинством физиков и химиков 1-й половины XIX в., которые не смогли отчётливо понять различия между атомом и молекулой. Тем не менее, в середине XIX века метод определения молекулярных масс по плотности паров получил широкое распространение.
Изучив составленные Дальтоном таблицы атомных весов, английский химик Уильям Праут высказал в 1815-1816 гг. предположение о том, что атомные веса всех элементов должны быть целочисленны и кратны атомному весу водорода. Причина этого, по мнению Праута, состоит в том, что именно водород – основа всех остальных элементов (протил, своего рода аналог первичной материи античных философов). Впрочем, эта точка зрения, известная как гипотеза Праута, хотя и произвела значительное впечатление на современников, не получила широкого признания вследствие явных противоречий с опытными данными.
Закон удельных теплоёмкостей открыли в 1819 г. французские учёные Пьер Луи Дюлонг и Алексис Терез Пти. Дюлонг и Пти показали, что удельная теплоёмкость твёрдых элементов (точнее говоря, простых веществ в твёрдом состоянии) обратно пропорциональна атомному весу; метод Дюлонга-Пти, позволял, таким образом, определять атомные веса некоторых элементов.
Немецкий химик Эйльгард Мичерлих в 1819 г. нашёл, что соединения, образованные одинаковым количеством атомов, обладают одинаковой кристаллической формой и способны образовывать смешанные кристаллы. Закон изоморфизма Мичерлиха позволил экспериментаторам делать выводы о числе атомов, образующих молекулу соединения и, следовательно, определять атомные массы элементов.
Огромный вклад в развитие химической атомистики и в решение проблемы атомных весов внёс шведский химик Йёнс Якоб Берцелиус. С 1807 г. он занялся систематическим изучением элементного состава соединений, представив огромное количество доказательств в пользу закона постоянства состава. В 1814 г. Берцелиус опубликовал первую таблицу атомных весов, в которой были приведены атомные веса 41 элемента (для составления таблицы Берцелиусу потребовалось определить состав почти 2 000 соединений!). В основу своей шкалы атомных весов Берцелиус положил атомный вес кислорода, принятый равным 100. Для определения атомных весов Берцелиус также был вынужден сделать ряд допущений (в частности, сильные основания должны были иметь состав RO2), в результате чего атомные веса ряда элементов были определены неверно.
В 1814 г. Берцелиус подробно изложил также систему химических знаков, основанную на обозначении элементов одной или двумя буквами латинского названия элемента; число атомов элемента предлагалось указывать надстрочными цифровыми индексами (принятое в настоящее время указание числа атомов подстрочными цифрами предложил в 1834 г. Юстус Либих). Система химических знаков Берцелиуса, альтернативная крайне неудобной системе Дальтона, получила всеобщее признание и сохранилась до настоящего времени.
В дальнейшем Берцелиус продолжал работы по уточнению и исправлению атомных весов элементов, используя для этой цели законы Мичерлиха, Гей-Люссака, Дюлонга и Пти (не воспользовавшись, однако, гипотезой Авогадро; Берцелиус считал, что в равных объёмах газов содержится одинаковое число атомов.). Новые, всё более точные таблицы атомных весов Берцелиуса выходят в 1818 и 1826 годах. В последней таблице значительные ошибки имеют место лишь для атомных весов некоторых металлов.
Сводная таблица атомных весов.
| Элемент | Атомная масса | |||
| По Дальтону (1810) | По Авогадро (1821) | По Берцелиусу (1826) | Современное значение | |
| O Cl I F N S P B C H Se As Mo Te Pt Cr W Sb Si Au Pd Hg Cu Ni Sn Pb Fe Zn Mn Al Mg Ca Na Ag Bi K Ba Sr | 7 - - - 5 13 9 - 5.4 1 - 42 - - 100 - 56 40 - 140 - 167 56 - 50 95 50 56 40 - - - - 100 68 - - - | 16.1 33.74 - 16.3 13.97 32.6 32 14.7 12.08 - - 75 - - 389 - - 129 31.6 398 - 405 127 - 235 414 108.5 129 114 36 94 82 90 216 - 78 274 175 | 16.03 35.47 123.21 18.73 14.19 32.24 31.44 21.79 12.25 1 79.26 75.33 95.92 129.24 194.75 56.38 189.62 129.24 44.47 199.21 114.53 202.86 63.42 59.24 117.84 207.46 54.36 64.62 57.02 27.43 25.38 41.03 46.62 216.61 213.21 79 137 88 | 16.00 35.45 126.91 19.00 14.01 32.06 30.97 10.81 12.01 1.01 78.96 74.92 95.94 127.60 195.09 52.00 183.85 121.75 28.09 196.97 106.4 200.59 63.55 58.71 118.69 207.19 55.85 65.37 54.94 26.98 24.31 40.08 22.99 107.87 208.98 39.10 137.34 87.62 |
Тем не менее, в первой половине XIX века продолжала существовать путаница в понятиях атом, молекула и эквивалент (и, разумеется, соответствующих массах). Авогадро, в противовес Дальтону и Берцелиусу, отрицающим существование двухатомных молекул элементарных газов, развивал свою молекулярную теорию, органично дополнявшую атомистику Дальтона. В 1821 г. Авогадро опубликовал работу, где привёл правильные формулы ряда соединений (например, для оксида бора – B2O3 вместо BO2 по Берцелиусу, и т.п.) и предложил свою таблицу атомных весов. Впрочем, несмотря на преимущества теории Авогадро, его таблица содержала много ошибочных данных (см. табл.).
Путанице в химической теории способствовало и учение об эквивалентах, которое развивал английский учёный Уильям Гайд Волластон. В работе "Синоптическая шкала химических эквивалентов" (1814) Волластон привёл таблицу эквивалентных масс элементов, которые большей частью совпадали с величинами атомных весов по Дальтону. Однако Волластон противопоставлял понятие "эквивалент" дальтоновскому понятию "атом". Многим химикам эквивалентные (соединительные) веса, казались более удобными и точными, чем атомные, поскольку они рассчитываются без принятых Дальтоном допущений. В 30-е годы XIX века учение об эквивалентах получило поддержку со сторону физиков – Майкл Фарадей открыл законы электролиза и экспериментально установил значения электрохимических эквивалентов.
В результате широчайшего распространения "Руководства по теоретической химии" (1817-1819), которое написал немецкий учёный Леопольд Гмелин, учение о соединительных весах получило почти всеобщее признание среди химиков-неоргаников. Гмелин принимал атомную массу кислорода равной 8, а не 16, как у Берцелиуса; "исправлению" подверглись и атомные массы ряда других элементов. Печальным следствием стал тот факт, что, например, для уксусной кислоты химиками в 30-40-е годы XIX века предлагалось 19 различных брутто-формул!
Попытки чётко разделить понятия предприняли в 40-е годы химики-органики. Шарль Жерар и Огюст Лоран развили идеи Авогадро, настаивая на необходимости установления чёткого различия между понятиями "атом", "молекула" и эквивалент".
Окончательную ясность в атомно-молекулярную теорию внёс Международный конгресс химиков, собравшийся 3 сентября 1860 года в Карлсруэ. Новую систему понятий, основанную на идеях Авогадро, изложил в своём докладе итальянский химик Станислао Канниццаро. Конгресс в Карлсруэ ознаменовал долгожданное решение проблемы атомных весов, чётко разграничив понятия "атом", "молекула" и "эквивалент"; понятие "эквивалент" было решено считать чисто эмпирическим и не зависящим от понятий "атом" и "молекула". Определения атомных масс химических элементов, которые выполнил в первой половине 1860-х годов бельгийских химик Жан Серве Стас, до конца XIX века считались наиболее точными.
Реформа Канниццаро завершила период, основным содержанием которого явилось установление количественных законов. Решения конгресса в Карлсруэ оказали большое влияние на дальнейшее развитие химии, сделав возможными последовавшие вскоре систематизацию химических элементов и создание периодического учения.
Электрохимические теории сродства
Создание Дальтоном атомной теории вновь поставило "проклятый вопрос атомизма" – вопрос о способе соединения атомов. Алессандро Вольта в 1800 г. представил доказательство несомненной связи между химическими реакциями и электричеством в виде первой электрической батареи ("Вольтов столб"). Последовавшие за этим блестящие успехи применения электричества в химии (разложение воды, выделение щелочных и щелочноземельных металлов) способствовали всеобщему убеждению естествоиспытателей в том, что силы, соединяющие атомы, должны иметь электрическую природу.
Первую электрохимическую теорию химического сродства предложил в 1807 г. английский учёный Гэмфри Дэви. Основные идеи теории состояли в следующем:
1. Атомы, способные соединяться химически, приобретают при контакте противоположные заряды;
2. Акт химической реакции представляет собой соединение атомов за счёт сил электростатического притяжения, при котором происходит компенсация зарядов;
3. Химическое сродство атомов пропорционально их полярности (величине возникающего заряда).
4. Если подействовать на соединение электричеством, атомы восстанавливают полярность и движутся к электродам.
Развивая представления Дэви, Й. Я. Берцелиус разработал в 1811-1818 гг. собственную электрохимическую теорию сродства. На основании изучения продуктов разложения солей, кислот и оснований, выделяющихся на электродах, Берцелиус создал весьма простую и наглядную дуалистическую систему:
1. Все атомы (простые и сложные) электрически заряжены и биполярны; при этом один из зарядов преобладает;
2. Соединение атомов сопровождается частичной нейтрализацией их зарядов;
3. При пропускании электрического тока атомы восстанавливают начальную полярность;
4. Химическое сродство пропорционально полярности веществ и температуре.
Все элементы Берцелиус расположил в ряд по знаку и величине присущего их атомам заряда. В начале электрохимического ряда располагался абсолютно электроотрицательный кислород, далее – электроотрицательные элементы (неметаллы) и переходный (индифферентный) элемент водород (оксид которого – ни кислота, ни основание). За водородом следовали переменные (одни оксиды которых – кислоты, другие – основания) и электроположительные элементы (щелочные и щелочноземельные металлы).
Кроме электрохимического ряда элементов, имелся и электрохимический ряд сложных атомов оксидов, в котором кислоты (кислотные оксиды по современной классификации) являлись электроотрицательными, а основания – электроположительными.
Все химические реакции сводились, таким образом, к взаимодействию зарядов. Берцелиус писал: "Сернокислый натрий составлен не из серы, кислорода и натрия, а из серной кислоты и натра, которые, в свою очередь, могут быть разделены на электроположительную и электротрицательную части". Учитывая, что под термином "серная кислота" Берцелиус, в соответствие с теорией кислот Лавуазье, подразумевает оксид серы SO3, образование сульфата натрия можно описать следующей схемой:
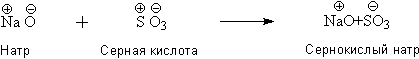
Для объяснения образования гидратных соединений Берцелиус предполагал, что вода может быть либо электроположительной, либо электроотрицательной частью соединения:

Несмотря на присущие недостатки, дуалистическая теория Берцелиуса (кстати, очень хорошо согласующаяся с представлениями Лавуазье о природе солей, кислот и оснований) весьма удачно объясняла многие реакции между неорганическими веществами. Положение о том, что молекула химического соединения построена из радикалов, способных к самостоятельному существованию, оказало существенное влияние на развитие теорий структурной химии. Отголоски электрохимических представлений Берцелиуса нетрудно найти в современной теоретической неорганической химии (электроотрицательность, поляризуемость и поляризующее действие ионов и т.п.). В XIX веке система Берцелиуса несколько десятилетий представляла собой одну из теоретических основ химии.
5. ПЕРИОД КЛАССИЧЕСКОЙ ХИМИИ
5.1. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Первые попытки систематизации - Таблица Ньюлендса - Таблица Мейера - Таблица Менделеева - Развитие Периодического закона
Первые попытки систематизации элементов
Одной из важнейших проблем теоретической химии XIX века после разрешения проблемы атомных весов оставалась систематизация химических элементов, число которых постоянно росло. Со времён античности и средних веков были известны 14 элементов (хотя собственно элементами их стали считать лишь в конце XVIII века). В XVIII веке к ним добавилось 20 новых элементов; к 1860 году число известных элементов возросло до шестидесяти. Проблема упорядочения элементов и отыскания закономерности в изменении их свойств становилась всё более актуальной.
Первую попытку систематизации элементов предпринял немецкий химик Иоганн Вольфганг Дёберейнер, сформулировавший в 1829 г. закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов:
| Cl – 35.5 Br – 80 I – 125 | P – 31 As – 75 Sb – 122 | S – 32 Se – 79 Te – 129 | Ca – 41 Sr – 88 Ba – 137 | Li – 7 Na – 23 K – 39 |
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
В 1843 г. Леопольд Гмелин привёл таблицу химически сходных элементов, расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз.
Важным этапом систематизации элементов стали т.н. дифференциальные системы, направленные на выявление общих закономерностей в изменении атомного веса элементов. В 1850 г. немецкий врач Макс фон Петтенкофер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т.е. в рядах соединений, отличающихся друг от друга группой CH2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании Петтенкофер высказал предположение, что элементы, возможно, являются сложными образованиями каких-то субэлементарных частиц. На следующий год подобные соображения высказал и французский химик-органик Жан Батист Андрэ Дюма. В 1859 г. эту идею детально разработал немецкий учёный Адольф Штреккер; несколько вариантов таблиц предложил в 1857-1868 гг. английский химик Уильям Одлинг.
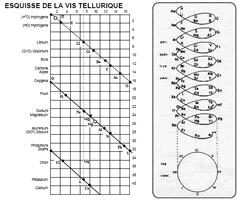
|
| Винтовой график Шанкуртуа, 1862 г. |
Александр Эмиль Бегуйе де Шанкуртуа в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов – т. н. "земная спираль" (vis tellurique). Шанкуртуа нанёс на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие элементам. Таким образом, элементы, атомные веса которых отличались на 16, или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной прямой. Винтовой график Шанкуртуа фиксировал закономерные отношения между атомными массами элементов, однако данная система не могла быть признана удовлетворительной.
Джон Александр Рейна Ньюлендс в 1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав чрезвычайно скептически.
Таблица Ньюлендса, 1864.
| № | № | № | № | № | № | № | № | ||||||||
| H | F | Cl | Co Ni | Br | Pd | I | Pt Ir | ||||||||
| Li | Na | K | Cu | Rb | Ag | Cs | Tl | ||||||||
| Be | Mg | Ca | Zn | Sr | Cd | Ba V | Pb | ||||||||
| B | Al | Cr | Y | Ce La | U | Ta | Th | ||||||||
| C | Si | Ti | In | Zr | Sn | W | Hg | ||||||||
| N | P | Mn | As | Di Mo | Sb | Nb | Bi | ||||||||
| O | S | Fe | Se | Rh Ru | Te | Au | Os |
В том же году Уильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил следующую таблицу, не сопровождаемую какими-либо пояснениями:
| Триплетные группы | ||||
| H 1 | Mo 96 | W 184 | ||
| Au 196.5 | ||||
| Pd 106.5 | Pt 197 | |||
| Li 7 | Na 23 | - | Ag 108 | |
| G 9 | Mg 24 | Zn 65 | Cd 112 | Hg 200 |
| B 11 | Al 27.5 | - | - | Tl 203 |
| C 12 | Si 28 | - | Sn 118 | Pb 207 |
| N 14 | P 31 | As 75 | Sb 122 | Bi 210 |
| O 16 | S 32 | Se 79.5 | Te 129 | |
| F 19 | Cl 35 | Br 80 | J 127 | |
| K 39 | Rb 85 | Cs 133 | ||
| Ca 40 | Sr 87.5 | Ba 137 | ||
| Ti 40 | Zr 89.5 | - | Th 231 | |
| Cr 52.5 | V 138 | |||
| Mn 55 и др. (Fe,Ni,Co,Cu) |
Несколько попыток систематизации элементов предпринял в 60-е годы XIX века немецкий химик Юлиус Лотар Мейер.
Дата добавления: 2015-04-15; просмотров: 1499;
