Важнейшие алхимические знаки 6 страница
Огромный вклад в изучение состояния химического равновесия внёс Якоб Генрик Вант-Гофф, опубликовавший в 1884 г. фундаментальную работу "Этюды химической динамики", в которой, связав представления о химическом равновесии с двумя началами термодинамики, рассмотрел влияние температуры на химическое равновесие. Вант-Гофф вывел формулу изохоры химической реакции:
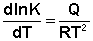 ,
,
где К – константа равновесия, Q – теплота реакции.
Вант-Гофф сформулировал также принцип подвижного равновесия и на многих примерах показал, что этот принцип выполняется для любых типов равновесных систем: "Каждое равновесие… при понижении температуры смещается в сторону той системы, при образовании которой выделяется теплота". В 1885 г. он термодинамически вывел закон действующих масс Гульдберга-Вааге; вывод уравнения изотермы химической реакции, связывающего константу равновесия с термодинамическими потенциалами осуществил в 1886 г. французский физик Пьер Дюгем.
Принцип подвижного равновесия в 1884 г. обобщил Анри Луи Ле Шателье, распространив его не только на термические, но и на любые другие изменения: "Когда любая химическая система, находящаяся в устойчивом равновесии, испытывает влияние посторонней силы, которая стремится изменить её состояние..., в ней наступают такие внутренние изменения, которые, идя сами по себе, вызвали бы изменения давления, температуры и концентрации, но обратного знака". В 1887 г. независимо от Ле Шателье этот общий принцип сформулировал немецкий учёный Фердинанд Браун. Принцип Ле Шателье – Брауна стал одним из важнейших теоретических обобщений химической термодинамики, которое справедливо для любых систем, находящихся в состоянии истинного равновесия.
Создание учения о химическом равновесии стало одним из главных достижений физической химии XIX века, имевшим значение не только для химии, но и для всего естествознания. Именно исследование химического равновесия положило начало изучению зависимости хода и результата химического процесса от таких факторов, как температура, давление, концентрации реагентов, природа растворителя и прочих внешних условий.
Химическая кинетика
Параллельно с изучением состояния химического равновесия началось активное изучение такой важной характеристики химического процесса, как скорость реакции и зависимость её от внешних условий. В 1850 г. немецкий химик Людвиг Фердинанд Вильгельми опубликовал работу "Закон действия кислот на тростниковый сахар", в которой впервые ввёл понятие скорости химической реакции как изменения количества вещества в единицу времени. Вильгельми показал, что скорость инверсии (в данном случае гидролиза) сахарозы прямо пропорциональна произведению количеств сахара и кислоты. Хотя предложенная Вильгельми формула представляет собой простейшей вид общего кинетического закона, до создания учения о химическом равновесии труд Вильгельми оставался совершенно незамеченным.
В 1862 г. Марселен Бертло и Луи Пеан де Сен Жилль установили зависимость между состоянием равновесия и скоростью химической реакции, представляя равновесие как состояние равенства скоростей прямой и обратной реакций. Они показали, что скорость реакции этерификации прямо пропорциональна произведению количеств исходных веществ. За работой Бертло и Сен Жилля последовали многочисленные систематические исследования взаимосвязи реакционной способности соединения и его химического строения, которые выполнил в 1877-1884 гг. русский химик Николай Александрович Меншуткин.
Существенным недостатком первых работ по химической кинетике был неудачный выбор главной кинетической характеристики, в качестве которой обычно принималась "начальная скорость". В 1884 г. Вант-Гофф предложил использовать константу скорости реакции – количество, превращающееся за одну минуту при концентрации, равной единице, – в качестве меры реакционной способности вещества. В уже упоминавшейся работе "Этюды химической динамики" Вант-Гофф привёл общую формулу скорости "нормальной" химической реакции, ставшую основным постулатом химической кинетики – скорость реакции прямо пропорциональна произведению концентраций реагентов, возведённых в некоторую степень:
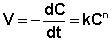 ,
,
где V – скорость реакции, С – концентрация, n – порядок реакции, t – время.
Вант-Гофф предложил также классификацию реакций на моно-, би- и тримолекулярные в зависимости от числа молекул, при взаимодействии которых происходит превращение, и простое эмпирическое правило, учитывающее влияние температуры на константу скорости реакции – правило Вант-Гоффа. Вильгельм Фридрих Оствальд в 1886 г. разработал классификацию химических реакций по величине порядка кинетического уравнения реакции (порядка реакции).
Для более точного описания зависимости константы скорости от температуры Сванте Август Аррениус высказал предположение, что взаимодействие происходит только при столкновении т.н. "активных" молекул, количество которых резко возрастает с повышением температуры. Аррениус предложил простое уравнение (известное ныне как уравнение Аррениуса), хорошо описывающее данную зависимость:
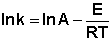 или
или 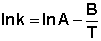
где Е – энергия активации, Т – температура, А и В – некоторые постоянные.
Кинетические законы, предложенные Вант-Гоффом и Аррениусом, стали основой для всех последующих исследований скорости и механизма химических реакций и их зависимости от различных факторов.
Катализ
Уже в начале XIX века имелись наблюдения, указывающие на то, что некоторые химические процессы не могут быть объяснены широко распространённым понятием химического сродства. В 90-х годах XVIII века французские химики Никола Клеман и Шарль Бернар Дезорм, изучавшие камерный процесс получения серной кислоты окислением серы в присутствии селитры, показали, что оксиды азота играют роль "передатчика" кислорода сернистой кислоте. Количество "азотистого газа" в ходе процесса не изменяется. Исследование, выполненное Клеманом и Дезормом, представляет собой первое описание каталитического процесса.
Вскоре появляется множество сообщений о реакциях, вызванных присутствием различных дополнительных агентов. В 1811 г. русский химик Константин Сигизмундович Кирхгоф открыл реакцию превращения крахмала в глюкозу в присутствии кислоты, количество которой в ходе реакции существенно не уменьшается. Французский химик Луи Жак Тенар описал в 1818 г. распад аммиака и перекиси водорода на некоторых металлах и оксидах, которые при этом не претерпевают никаких изменений. Г. Дэви и И. В. Дёберейнер установили в 1816-1821 гг., что порошкообразная платина (платиновая чернь) многократно ускоряет присоединение водорода к кислороду и органическим соединениям, а также окисление органических соединений кислородом. В результате многочисленных исследований взаимодействия газов в присутствии металлов в 1831 г. был запатентован контактный способ промышленного получения серной кислоты в присутствии платины.
В 1834 г. Э. Мичерлих сделал первые обобщения в области каталитических реакций; он установил, что серная кислота в реакциях этерификации играет роль не водоотнимающего средства, как было принято считать, а контакта (катализатора). Мичерлих показал схожесть между собой множества разнообразных процессов, которые вызываются присутствием различных по своей природе веществ, не претерпевающих в процессе реакции никаких изменений, объединив их термином "контактные явления". В 1835-1836 гг. Й. Я. Берцелиус опубликовал серию работ, также обобщающих данные явления, предложив вместо термина "контакт" термин "катализатор". Берцелиус попытался дать объяснение закономерностям каталитических процессов, например, специфичности катализаторов, выдвинув предположение о существовании некоторых каталитических сил: "Каталитическая сила… заключается в том, что благодаря одному её присутствию, а не благодаря её сродству, могут пробуждаться дремлющие при этой температуре сродства, а вследствие влияния последних элементы сложного тела перегруппировываются в других соотношениях".
С Берцелиусом вступил в полемику по этому вопросу Ю. Либих, считавщий предложенное понятие каталитической силы не только неверным, но вредным для развития науки. В 1839 г. Либих высказал свою точку зрения на природу катализа, предложив гипотезу молекулярных ударов, согласно которой катализатор, находясь в состоянии "усиленного движения составных частей" передаёт свои колебания частицам реагентов, повышая их активность. Несмотря на различие подходов, взгляды Берцелиуса и Либиха близки тем, что оба считали взаимодействие катализатора и реагентов нестехиометрическим.
В русской школе органической химии широкое распространение приобрело стехиометрическое объяснение каталитических процессов, предложенное Г. И. Гессом, заключающееся в предположении, что катализатор образует с одним из реагентов промежуточное соединение постоянного состава, которое затем взаимодействует с другим реагентом, высвобождая катализатор. Сторонники этих взглядов, к числу которых относились, например, А. М. Бутлеров и В. В. Марковников, считали, что каталитические реакции не отличаются принципиально от некаталитических. Следует отметить, что теории промежуточных соединений оказались чрезвычайно плодотворными в классическом органическом синтезе, однако они были совершенно неприменимы к гетерогенным каталитическим процессам.
Адекватное объяснение каталитическим явлениям удалось дать лишь благодаря успехам химической кинетики и химической термодинамики. В 90-х годах XIX века Вильгельм Оствальд опубликовал серию ставших классическими работ по катализу, в которых определил катализатор как "вещество, которое изменяет скорость реакции, не появляясь в конечном продукте реакции". Оствальд доказал, что катализаторы не изменяют состояния химического равновесия, а лишь ускоряют его достижение, заложив в своих статьях основы термодинамики и кинетики каталитических процессов. Избрав в качестве меры каталитического действия изменение константы скорости реакции, он положил начало количественным исследованиям в данной области.
Учение о растворах
Важнейшей составной частью физической химии в XIX веке стало учение о растворах. Начало систематическим исследованиям растворов положили опыты, которые проводили в 30-е гг. XVIII в. Рене Антуан Реомюр с водно-спиртовыми растворами и Герман Бургаве с растворами неорганических солей. Немецкий химик Фридрих Гофман и несколько позднее Бургаве в своём популярном учебнике "Элементы химии" (1732 г.) высказали предположение о том, что при растворении происходит соединение растворителя с растворяемым веществом. Точка зрения Гофмана и Бургаве на некоторое время вытеснила в химии т.н. корпускулярную теорию растворения, рассматривавшую растворение как простое смешение разнородных корпускул.
В начале XIX века среди химиков широко распространились два различных взгляда на природу растворов: Клод Луи Бертолле рассматривал растворы как неопределённые (нестехиометрические) соединения, а Йёнс Якоб Берцелиус считал их механическими смесями, при образовании которых не действуют силы химического сродства, поскольку растворы не подчиняются закону постоянства состава. Развившиеся из этих представлений физическая и химическая теории растворов на протяжении всего XIX века существовали параллельно, и каждая из них могла предложить веские экспериментальные свидетельства в свою пользу.
Активным и последовательным сторонником химической теории растворов являлся Д. И. Менделеев, доказывавший свою позицию такими аргументами, как тепловые и объёмные эффекты при растворении, существование определённых соединений растворителя и растворённого вещества в растворе и в твёрдом состоянии.
Физическая теория растворов в свою очередь достигла существенных успехов в количественном описании некоторых свойств растворов. В 1882-1887 гг. Франсуа Мари Рауль открыл закон упругости пара растворов и закон криоскопии (известные сейчас соответственно как 1-й и 2-й законы Рауля). Криоскопический метод определение молекулярной массы веществ, который ввёл в практику в 1888 г. Эрнст Отто Бекман оказался настолько простым и быстрым, что вытеснил метод, основанный на определении плотности пара.
В 1886-1887 гг. Якоб Генрик Вант-Гофф опубликовал блестящие обобщающие статьи, в которых показал, что газовые законы целиком справедливы и для сильно разбавленных растворов; роль газового давления играет осмотическое давление раствора. Вант-Гофф увязывал свои выкладки с экспериментальными результатами Рауля о понижении давления пара, повышении температуры кипения и понижении температуры замерзания разбавленных растворов. Осмотическая теория Вант-Гоффа предоставила в распоряжение химиков сразу несколько способов определения молекулярной массы веществ, что заставило пользоваться её практическими следствиями даже тех химиков, которые отрицательно относились к физической теории растворов.
Уже в момент появления осмотическая теория испытывала затруднения, касающиеся растворов солей, кислот и оснований, проводящих электрический ток – электролитов. Вант-Гофф был вынужден ввести в свои формулы поправочный изотонический коэффициент. Однако эти затруднения теории превратились в самую блестящую её часть – теорию электролитической диссоциации.
Следует упомянуть о том, что первое предположение о способности солей расщепляться в воде на свои полярно-электрические простейшие части без действия электрического тока высказывал в 1805-1818 гг. Теодор фон Гротгус; однако его идеи в период господства электрохимической теории Берцелиуса оказались забытыми. Рудольф Клаузиус в 1857 г. также предлагал гипотезу о том, что соли в растворе в некоторой степени распадаются на два иона даже в тех случаях, когда ток через раствор не протекает.
Создателем теории электролитической диссоциации стал шведский химик Сванте Аррениус, который в 1887 г. показал, что изотонический коэффициент Вант-Гоффа, стремящийся при разбавлении раствора к целочисленному значению, имеет физический смысл числа ионов, на которые распадается в растворе молекула электролита. Таким образом, все аномалии осмотической теории стали блестящим доказательством теории электролитической диссоциации. Аррениус вывел формулу, связывавшую степень диссоциации и изотонический коэффициент.
Важным выводом теории электролитической диссоциации стало представление реакции нейтрализации в виде взаимодействия иона водорода с гидроксид-ионом. Это заключение Аррениуса удачно объяснило открытый Г. Гессом закон термонейтральности – одинаковые величины теплот нейтрализации сильных кислот сильными основаниями. В течение нескольких лет многочисленные исследования С. Аррениуса, В. Оствальда, В. Нернста и многих других учёных не только подтвердили справедливость основных положений теории электролитической диссоциации, но и существенно увеличили число экспериментальных фактов, объяснение которым можно было найти с применением теории Аррениуса.
Созданная Вант-Гоффом и Аррениусом теория растворов никоим образом не являлась всеобъемлющей. К концу XIX века стало очевидно, что физическая и химическая теории растворов не взаимоисключающи, как считалось ранее, но дополняют друг друга; каждая представляет собой лишь крайний и односторонний подход к рассмотрению проблемы.
Итоги развития химии в XIX веке
В целом химическая теория периода классической химии к концу XIX века получила относительное завершение. В начале века теоретическую основу химии составляли закон сохранения массы и закон постоянства состава. Во второй половине века химическая теория обогатилась периодическим законом химических элементов, учением о химическом строении молекул, законами химической термодинамики и химической кинетики. Такое расширение круга основополагающих химических теорий в сочетании с огромным количеством накопленных экспериментальных данных позволило учёным далеко продвинуться на пути решения основной задачи химии – получения вещества с заданными свойствами. Успехи химической теории способствовали блестящим достижениям органического синтеза, прикладной неорганической и органической химии, химической технологии и металлургии.
К концу века чётко оформились три концептуальных системы химии: учение о составе, структурная химия и учение о химическом процессе. Однако в каждой из основных концепций химии оставались нерешёнными фундаментальнейшие вопросы: о причине периодичности свойств элементов, о природе связи между атомами, о природе сил химического сродства. Ответить на эти вопросы предстояло химии XX столетия, начало которого ознаменовалось общим кризисом естествознания, вылившимся в новую научную революцию: закачался казавшийся незыблемым фундамент всей науки – атомно-молекулярная теория.
6. ХИМИЯ XX ВЕКА
Делимость "неделимого" - Модели атома - Химическая связь - Квантовая химия
"Делимость неделимого"
Открытие делимости атома, ознаменовавшее собой конец господствовавшего в естествознании механистического атомизма, произошло на рубеже XX века. Это открытие имеет достаточно длинную предысторию. Уже в 1870-е годы, после создания периодического закона химических элементов, среди естествоиспытателей вновь возродился интерес к гипотезе Уильяма Праута (см. главу IV). Хотя точнейшие определения атомных весов и показали, что в ряде случаев их нецелочисленность нельзя объяснить ошибками опыта, гипотеза о протиле – некоей простейшей составной части атома вновь стала активно обсуждаться. Английский астрофизик Джозеф Норман Локьер, изучавший спектры звёзд и показавший, что они состоят в основном из водорода, выступил в 1873 г. с идеей эволюции элементов. Широкую известность получила книга "О происхождении химических элементов", которую написал в 1886 г. английский физик Уильям Крукс, крупный специалист в области спектрального анализа. Крукс полагал, что все элементы произошли из протила, каковым, по-видимому, является водород, "…путём эволюции, подобно тому, как произошли члены нашей солнечной системы согласно теории Лапласа, и как произошли растения и животные нашей планеты – по Ламарку, Дарвину и Уоллесу". У гипотезы об эволюции элементов было, впрочем, немало противников, указывавших, что эта гипотеза не имеет никаких экспериментальных оснований.
Основной экспериментальной предпосылкой установления делимости атома стали исследования электрического тока, проводимые физиками на протяжении всего XIX века. В 1874 г. ирландский физик Джордж Джонстон Стоуни высказал идею о том, что электричество состоит из элементарных зарядов, связанных с атомами, и вычислил величину этого элементарного заряда; в 1891 г. Стоуни предложил для него термин электрон.

|
| Трубка Крукса |
Исследования электрических разрядов в разреженных газах и вакууме, которые начал в 1859 г. немецкий физик Юлиус Плюккер, привели к тому, что Вильгельм Гитторф и Уильям Крукс открыли в 1869-1875 гг. невидимые катодные лучи, распространяющиеся в вакууме от катода к аноду. Природа катодных лучей, которые распространяются прямолинейно и вызывают флюоресценцию (свечение) стекла вокруг анода, долгое время оставалась неизвестной; немецкие физики предполагали волновую, английские – корпускулярную природу катодных лучей. В 1886 г. немецкий физик Эуген Гольдштейн, экспериментируя с решетчатым катодом, открыл каналовые лучи, распространяющиеся противоположно катодным; была высказана гипотеза о том, что каналовые лучи состоят из положительно заряженных частиц.
В 1895 г. французский физик Жан Батист Перрен обнаружил отклонение катодных лучей электрическим полем, доказав тем самым, что они представляют собой поток отрицательно заряженных частиц. Наконец, в 1897 г. англичанин Джозеф Джон Томсон и немецкий физик Эмиль Вихерт независимо друг от друга определили отношение заряда электрона к его массе, окончательно доказав его существование. Масса электрона, по их данным, составляла от 1/4000 до 1/2000 массы атома водорода; было замечено также, что масса электрона зависит от его скорости (точное значение заряда электрона определил в 1917 г. английский физик Роберт Эндрюс Милликен). Дж. Дж. Томсон сразу же высказал предположение о том, что электроны являются составной частью атома.
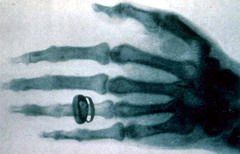
|
| Одна из первых рентгенограмм - фотография руки жены В. Рёнтгена в X-лучах |
Изучение катодных лучей привело и к другому важному открытию. Вильгельм Конрад Рёнтген обнаружил в 1895 г., что при падении катодных лучей на антикатод возникает новый вид излучения – X-лучи (рентгеновские лучи), которые обладают высокой проникающей способностью и вызывают флюоресценцию различных веществ. Природа рентгеновских лучей также поначалу истолковывалась по-разному – помимо мнения, что X-лучи сходны с ультрафиолетом, высказывались и предположения об их корпускулярной природе. Окончательно волновая природа X-лучей была доказана лишь в 1913 г., когда Макс Теодор Феликс фон Лауэ обнаружил их дифракцию при прохождении через кристаллы.
Пытаясь проверить высказанное французским математиком Анри Пуанкаре предположение о том, что X-лучи не связаны с катодными лучами, Антуан Анри Беккерель начал изучение флюоресценции солей урана. Беккерель опубликовал сообщение о том, что сульфат уранила после облучения солнечным светом даёт излучение, засвечивающее завёрнутую в чёрную бумагу фотопластинку. Однако уже через несколько дней Беккерель обнаружил, что соли урана вызывают почернение фотопластинок, даже не будучи облучёнными солнечным светом: они постоянно испускают проникающее излучение. Следует отметить, что о способности нитрата уранила разлагать соли серебра в темноте сообщал ещё в 1858 г. французский естествоиспытатель Ньепс де Сен-Виктор, однако его исследования в то время не вызвали интереса.

|
| Образец бромида радия, светящийся из-за высокой радиоактивности |
В 1897-1898 гг. французские учёные Пьер Кюри и Мария Склодовская-Кюри установили, что испускание уранового излучения является свойством атома урана; это свойство не зависит от того, в каком соединении находится уран. В 1898 г. супруги Кюри обнаружили, что таким же свойством обладает и другой элемент – торий. В том же году они начали исследования богемской смоляной обманки – одного из природных минералов урана, испускающим более сильное излучение (супруги Кюри предлагают термин радиоактивность), чем чистые соли урана. Результатом их работы стало открытие двух новых радиоактивных элементов – полония и радия.
В 1899 г. английский физик Эрнест Резерфорд обнаружил неоднородность уранового излучения: в магнитном поле лучи разделяются таким образом, что можно выделить две составляющих, соответствующих потокам частиц с положительными и отрицательными зарядами. Поль Виллар в 1900 г. выделил ещё один тип: лучи, не отклоняющиеся магнитным полем. Резерфорд предложил обозначать эти излучения первыми буквами греческого алфавита: альфа-лучи, бета-лучи и гамма-лучи. Беккерель показал, что β-лучи отклоняются магнитным полем в том же направлении и на ту же величину, что и катодные лучи, и, следовательно, представляют собой поток электронов.
В 1900 г. Резерфорд установил, что соединения тория непрерывно выделяют радиоактивный газ – эманацию тория (радон), положив тем самым начало исследованиям продуктов радиоактивного распада. В 1903 г. Уильям Рамзай, первооткрыватель инертных газов, и Фредерик Содди доказали, что при α-распаде радия образуется гелий. В том же году Э. Резерфорд и Ф. Содди заложили основы теории радиоактивного распада, показав, что уран, торий и актиний являются родоначальниками семейств радиоактивных элементов, являющихся продуктами их распада; конечным продуктом распада является свинец. В качестве важнейшей характеристики радиоактивных элементов было предложено введённое П. Кюри понятие период полураспада.
Исследования радиоактивности в корне изменили классическое понятие атома; стало очевидным, что атом надлежит понимать как сложную систему, в образовании которой участвуют некие более простые частицы. Хотя для химии установление делимости атома не привело к каким-либо принципиальным изменениям в теории, серьёзную проблему составляла необходимость размещения в периодической таблице элементов многочисленных продуктов радиоактивного распада, имеющих близкие атомные массы, но значительно отличающиеся периоды полураспада. С одной стороны, Теодор Сведберг в 1909 г. показал, что химически многие продукты радиоактивного распада тождественны. С другой стороны, было установлено, что атомные массы свинца и неона, полученных в результате радиоактивного распада, достоверно отличаются от атомных масс "обычных" элементов. Проблема была решена в 1913-1914 гг. Фредериком Содди. Химически неразличимые элементы, хотя бы и имеющие различные атомные массы – изотопы – Содди предложил размещать в одной ячейке периодической таблицы. Для определения места короткоживущих продуктов распада Содди предложил использовать закон сдвига, который одновременно с ним сформулировал в 1913 г. Казимир Фаянс. Согласно этому закону, продуктом α-распада является элемент, расположенный в периодической таблице на две клетки левее исходного, а продуктом β-распада – элемент, находящийся на одну клетку правее. Для обозначения атомов разных элементов, имеющих одинаковые массы, был предложен термин изобары.
В 1914 г. в распоряжении физиков и химиков появился способ непосредственного определения положения элемента в периодической таблице – английский физик Генри Гвин Джефрис Мозли установил, что корень из частоты характеристического рентгеновского излучения находится в линейной зависимости от целочисленной величины – атомного номера, который совпадает с номером элемента в периодической таблице. Закон Мозли позволил экспериментально подтвердить правильность размещения элементов, в том числе и радиоактивных изотопов, в периодической таблице; подтвердилась также справедливость отступления в ряде случаев порядка элементов от порядка возрастания атомных масс (т.н. аномалии периодической таблицы). Именно атомный номер, совпадающий, как предположил голландский учёный Антониус ван ден Брук, с величиной положительного заряда ядра атома, стал основой классификации химических элементов. В 1920 г. английский физик Джеймс Чедвик экспериментально определил ядерные заряды меди серебра и платины, получив для них значения 29.3, 46.3 и 77.4 соответственно, что практически совпадало с их атомными номерами: 29, 47 и 78.
К началу 20-х годов XX века изменилось само понятие химического элемента, берущее начало от Роберта Бойля. Вместо элемента как химически неразложимого вещества, состоящего из тождественных неделимых атомов, сформировалось представление об элементе как о совокупности атомов с одинаковым зарядом ядра. В 1919 г. Резерфорд осуществил первую искусственную ядерную реакцию, превратив азот в кислород бомбардировкой α-частицами, и экспериментально доказал существование протона; в 1920 г. он же высказал гипотезу о существовании нейтрона (который был экспериментально обнаружен Чедвиком в 1931 г.). Весьма примечательно, что название ядра простейшего атома – протон – созвучно праутовскому протилу.
Открытие основных составных частей атома и возможности превращений элементов (оказалось, алхимики были не столь уж и не правы, говоря о том, что трансмутация – лишь вопрос искусства!) привело к коренному пересмотру представлений о строении вещества. Алхимический термин трансмутация возвратился в науку; теперь он стал означать превращение атомов одних химических элементов в другие в результате радиоактивного распада их ядер либо ядерных реакций.
Модели строения атома
Первые модели строения атома появляются в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако наиболее широкое распространение получила т.н. кексовая модель атома: в 1902 г. Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон предложил способ определения числа электронов в атоме, основанный на рассеивании рентгеновских лучей, основанный на предположении, что именно электроны должны являться центрами рассеивания. Проведённые эксперименты показали, что количество электронов в атомах элементов равно приблизительно половине величины атомной массы. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов.
Дата добавления: 2015-04-15; просмотров: 1524;
