Важнейшие алхимические знаки 4 страница
В 1864 г. Мейер опубликовал свою первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов.
Таблица Мейера 1864 г. (фрагмент).
| 4 val | 3 val | 2 val | 1 val | 1 val | 2 val |
| C=12 | N=14.4 | O=16 | F=19 | Na=23 | Mg=24 |
| Si=28.5 | P=31 | S=32 | Cl=35.5 | K=39 | Ca=40 |
| ... | As=75 | Se=78.8 | Br=80 | Rb=85.4 | Sr=87 |
| Sn=117.6 | Sb=120.6 | Te=128.3 | I=126.8 | Cs=133 | Ba=137.4 |
| Pb=207 | Bi=208 | ... | ... | (Tl=204) | ... |
В 1870 году вышла ещё одна работа Мейера, содержащая новую таблицу и график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид.
Предложенная Мейером таблица "Природа элементов как функция их атомного веса" состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными.
Таблица Мейера 1870 г.
| I | II | III | IV | V | VI | VII | VIII | IX |
| B | Al | In (?) | Tl | |||||
| C | Si | Ti | Zr | Sn | Pb | |||
| N | P | V | As | Nb | Sb | Ta | Bi | |
| O | S | Cr | Se | Mo | Te | W | ||
| F | Cl | Mn Fe Co Ni | Br | Ru Rh Pd | I | Os Ir Pt | ||
| Li | Na | K | Cu | Rb | Ag | Cs | Au | |
| Be | Mg | Ca | Zn | Sr | Cd | Ba | Hg |
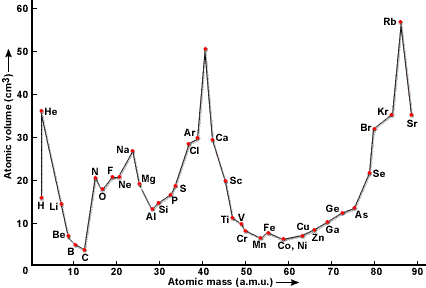
Зависимость атомного объёма от атомной массы элемента
В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях:
1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств;
2. Сходные по свойствам элементы имеют или близкие атомные веса (Os, Ir, Pt), или последовательно и однообразно увеличивающиеся (K, Rb, Cs);
3. Сопоставление элементов или их групп по величине атомного веса отвечает их т.н. валентности;
4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами;
5. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента;
6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с паем (атомной массой) 65-75.
В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
Первая таблица Менделеева (1869).
| H = 1 | Ti = 50 V = 51 Cr = 52 Mn = 55 Fe = 56 Co = Ni = 59 Cu = 63.4 | Zr = 90 Nb = 94 Mo = 96 Rh = 104.4 Ru = 104.4 Pd = 106.6 Ag = 108 | ? = 180 Ta = 182 W = 186 Pt = 197.4 Ir = 198 Os = 199 Hg = 200 | ||
| Be = 9.4 | Mg = 24 | Zn = 65.2 | Cd = 112 | ||
| B = 11 | Al = 27.4 | ? = 68 | Ur = 116 | Au = 197 | |
| C = 12 | Si = 28 | ? = 70 | Sn = 118 | ||
| N = 14 | P = 31 | As = 75 | Sb = 122 | Bi = 210 | |
| O = 16 | S = 32 | Se = 79.4 | Te = 128? | ||
| F = 19 | Cl = 35.5 | Br = 80 | J = 127 | ||
| Li = 7 | Na = 23 | K = 39 Ca = 40 ? = 45 ?Er = 56 ?Yt = 60 ?In = 75.6 | Rb = 85.4 Sr = 87.6 Ce = 92 La = 94 Di = 95 Th = 118? | Cs = 133 Ba = 137 | Tl = 204 Pb = 207 |
В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций).
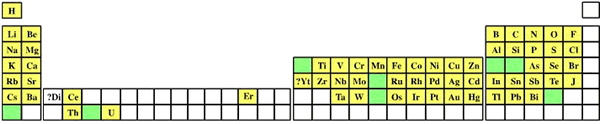
|
| Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев |
В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса. Тогда же Менделеев придал своей периодической таблице классический вид (т. н. короткая таблица).
В связи с периодической таблицей химических элементов иногда поднимается вопрос о приоритете. Здесь следует чётко отделять периодическую таблицу и периодический закон химических элементов. В таблицах Одлинга 1864 г., Менделеева 1869 г. и Мейера 1870 г. нельзя не отметить несомненного сходства; во всех таблицах оставлены места для неоткрытых элементов, и все они не лишены недостатков. Работа Мейера была сдана в печать в 1869 г.; после опубликования доклада Менделеева Мейер добавил в свою статью ссылку на Менделеева, где, в частности, особо указал, что предлагаемый им график прекрасно иллюстрирует предложенный русским химиком термин "периодичность". Таким образом, поскольку Менделеев и Мейер независимо друг от друга предложили весьма близкие варианты таблицы, используемое в некоторых странах название "таблица Менделеева-Мейера" можно считать не лишённым оснований.
Вместе с тем приоритет Менделеева в открытии периодического закона химических элементов является совершенно неоспоримым (сам Мейер на него никогда и не претендовал). Мейер, Шанкуртуа, Ньюлендс и Одлинг систематизировали элементы, указывая на наличие несомненной закономерности в численных величинах атомных весов. Однако никто до Менделеева не решился счесть эти закономерности общим законом природы. Заслуга Менделеева состоит в том, что он не просто расположил элементы в определённом порядке, но взял на себя смелость на основании предположения, что именно атомная масса предопределяет свойства элемента, изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов – прежде всего экабора, экаалюминия и экасилиция. Сам Менделеев по этому поводу высказался следующим образом: "Ни де Шанкуртуа, которому французы приписывают право на открытие периодического закона, ни Ньюлендс, которого выставляют англичане, ни Л. Мейер, которого цитировали иные как основателя периодического закона, не рисковали предугадывать свойства неоткрытых элементов, изменять принятые веса атомов и вообще считать периодический закон новым, строго поставленным законом природы, могущим охватывать ещё доселе необобщённые факты, как это сделано мною с самого начала (1869)".
Формулировка Менделеевым периодического закона и построение периодической таблицы означали лишь начало развития учения о периодичности свойств элементов. Предсказания Менделеева вначале были встречены с известным скепсисом; лишь после того, как были открыты предсказанные элементы, и обнаружено совпадение их реальных свойств с предсказанными, периодический закон был признан в качестве одного из фундаментальных законов химии. В развитии периодического закона принято выделять два этапа – химический и физический.
Развитие периодического закона
Химический этап развития периодического закона начался с открытия предсказанных элементов.
В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием. Менделеев сразу же указал, что галлий представляет собой экаалюминий. Дальнейшие исследования полностью подтвердили это, причём оказалось, что Менделеев предсказал плотность галлия точнее, чем Лекок де Буабодран экспериментально определил её.
В 1879 г. шведский химик Ларс Фредерик Нильсон опубликовал сообщение об открытии скандия. Свойства скандия в точности соответствовали свойствам менделеевского экабора.
В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий. Исследование свойств нового элемента показало, что он полностью идентичен с экасилицием Менделеева.
Полное подтверждение предсказаний Менделеева означало торжество периодического закона. С середины 1880-х годов учение о периодичности было окончательно признано в качестве одной из основ теоретической химии.
Тем не менее, в периодическом законе оставались некоторые проблемы. Предстояло определиться с местом в периодической таблице для двух групп элементов – инертных газов, имеющих нулевую валентность, и тринадцати редкоземельных элементов. Нельзя не упомянуть о том, что открытие большого числа элементов во второй половине XIX века было в значительной мере обусловлено появлением спектрального анализа, метода, который предложили в конце 1850-х годов немецкие учёные Густав Роберт Кирхгоф и Роберт Вильгельм Бунзен. В 1900-1902 гг. Д. И. Менделеев, Уильям Рамзай, первооткрыватель инертных газов, и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы. Менделеев и Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы. Нулевая группа прекрасно вписалась в периодическую таблицу; инертный газ явился элементом, переходным между галогенами и щелочными металлами. Браунер предложил решение проблемы размещения в таблице редкоземельных элементов. По его мнению, РЗЭ составляют особую группу периодической системы: "Подобно тому, как в Солнечной системе целая группа астероидов занимает полосу на месте пути, по которому должна бы двигаться одна планета, так точно целая группа элементов редких земель могла бы занять в системе одно место, на котором в другом случае стоит один элемент... Таким образом, все эти элементы, очень подобные один другому, стали бы на том месте в IV группе восьмого ряда, которое до сих пор занимал церий... Элементы редких земель создали бы особую интерпериодическую группу, аналогичную до некоторой степени восьмой группе, поместившись в середине остальных групп периодической системы..." Шестой период таблицы, таким образом, должен быть длиннее, чем четвёртый и пятый, которые в свою очередь длиннее, чем второй и третий периоды. В коротком варианте периодической таблицы Браунер предложил поместить все РЗЭ в одну клетку четвёртой группы.
Модернизация периодической системы в начале XX века завершила химический этап её развития. Химия в принципе не могла объяснить причину периодичности свойств элементов и их соединений. Дальнейшее развитие периодического закона в XX веке связано с блестящими успехами физики, приведшими к революционным изменениям в естествознании.
Физический этап развития периодического закона можно в свою очередь разделить на несколько стадий:
1. Установление делимости атома на основании открытия электрона и радиоактивности (1896 – 1897);
2. Разработка моделей строения атома (1911 – 1913);
3. Открытие и разработка системы изотопов (1913);
4. Открытие закона Мозли (1913), позволяющего экспериментально определять заряд ядра и номер элемента в периодической системе;
5. Разработка теории периодической системы на основании представлений о строении электронных оболочек атомов (1921 – 1925);
6. Создание основ квантовой теории периодической системы (1926 – 1932).
5.2. СТРУКТУРНАЯ ХИМИЯ
Возникновение структурной химии - Структурные теории - Стереохимия - Координационная химия
Возникновение структурной химии
В первой половине XIX века зародилась принципиально новая концепция химии – структурная химия, исходящая из предпосылки о том, что свойства вещества определяются не только его составом, но и структурой, т.е. порядком соединения атомов и их пространственным расположением. Самые первые структурные представления с необходимостью возникают вместе с атомистикой Дальтона. Развивая представления о способах объединения "простых атомов" в "сложные атомы", Дальтон преследовал лишь одну цель – создать теорию для объяснения эмпирически открытых стехиометрических законов. Тем не менее, сами избранные Дальтоном символы химических элементов предполагали при изображении сложных атомов выбор определённого порядка соединения атомов между собой. Однако вопрос о порядке соединения атомов оказался отложен на довольно долгое время, поскольку химики не имели никаких фактов, указывающих на влияние способа соединения атомов на свойства вещества. Химическая символика Берцелиуса позволила обойти этот вопрос, хотя и в электрохимической теории Берцелиуса всё же рассматриваются некоторые проблемы ("силы сцепления", "соположение" и т.п.), ставшие впоследствии фундаментальными вопросами структурной химии.
Возникновение структурной химии следует, видимо, связывать с открытием явления изомерии. В 1825 г. Иоганн Юстус фон Либих обнаружил, что элементный состав гремучей (фульминовой) кислоты в точности соответствует составу циановой кислоты, которую за год до этого получил Фридрих Вёлер. Повторные анализы, проведённые Вёлером и Либихом, однозначно установили существование веществ, одинаковых по составу, но различающихся по свойствам. Продолжая работы с циановой кислотой, Вёлер, выпаривая раствор изоцианата аммония, получил в 1828 г. изомерное органическое вещество – мочевину. В 1830 г. Й.Я.Берцелиус установил, что виноградная и виннокаменная кислоты также имеют одинаковый состав, но различаются по свойствам. Берцелиус предложил для обнаруженного явления термин "изомерия" (от греческого ισοζ μερον – равной меры). Вскоре обнаружилось, что это явление чрезвычайно распространено в органической химии. В состав органических веществ входит относительно небольшое число элементов – углерод, водород, азот, кислород, сера и фосфор (т.н. элементы-органогены) – при огромном разнообразии свойств. Именно поэтому на протяжении почти всего XIX века структурные представления оказались востребованы, прежде всего, в органической химии. Следует подчеркнуть, однако, что категорически не следует отождествлять понятия "структурная химия" и "органическая химия".
В основу решения вопроса о строении органических веществ было положено представления Берцелиуса о радикалах – полярных группах атомов (не содержащих кислорода), способных переходить из одних веществ в другие без изменения. Еще в 1810-1811 гг. Жозеф Луи Гей-Люссак и Луи Жак Тенар показали, что цианидный радикал CN ведёт себя как единичный атом (причём весьма сходный с атомом хлора или брома). Представления о радикалах, хорошо согласующиеся с электрохимической теорией Берцелиуса, позволили распространить эту теорию и на органические вещества.
Создание теорий структурной химии
Теория сложных радикалов возникла и стала активно разрабатываться многими химиками после работы Либиха и Вёлера "О радикале бензойной кислоты", вышедшей в 1832 г. Либих и Вёлер показали, что группировка атомов С14Н10О2 (правильная брутто-формула – С7Н5О) в цепи превращений бензойной кислоты (бензальдегид – бензойная кислота – бензоилхлорид – бензоилцианид) ведёт себя как единое целое – как некий "органический атом". Теория сложных радикалов быстро получила практически всеобщее признание. В 1837 г. в обобщающей статье "О современном состоянии органической химии", одним из авторов которой являлся Либих, утверждалось, что изучение сложных радикалов – основная задача органической химии, поскольку "циан, амид, бензоил, радикалы аммиака, жиров, алкоголя и его производных образуют истинные элементы органической природы, тогда как простейшие составные части – углерод, водород, кислород и азот – обнаруживаются лишь при разрушении органической материи". Количество описанных радикалов быстро возрастало. Теория сложных радикалов исходила из предположения, что радикалы способны к самостоятельному существованию, хотя химикам и не удавалось их выделить. Берцелиус по этому поводу писал: "Причина, по которой мы не можем изолировать радикалы… не в том, что они не существуют, а в том, что они слишком быстро соединяются".
В 1834 г. французский химик Жан Батист Андре Дюма описал явление металепсии – замещения водорода в органических соединениях хлором, при котором сохраняются основные свойства вещества, – получив из этанола (С2Н6О) хлораль (С2Н3Cl3О). Дюма (кстати, соавтор вышеупомянутой статьи Либиха) вначале не придал большого значения открытому явлению, но после получения им в 1839 г. хлоруксусной кислоты пересмотрел свои взгляды. Явление металепсии в корне противоречили электрохимическому дуализму Берцелиуса, попытки которого найти этим экспериментальным фактам какие-либо объяснения в рамках своей теории потерпели неудачу. Металепсия, однако, хорошо согласовывалась с законом изоморфизма Мичерлиха. Дюма в своих работах начал настойчиво развивать мысль о том, что свойства соединений, как показывают экспериментальные факты, определяются только расположением атомов в молекуле, а не их природой. Поэтому, считает Дюма, химикам надлежит заняться выявлением типов расположения атомов в молекуле. "Необходимо сделать вывод о том, что в органической химии существуют типы соединений, которые сохраняются даже в случае замещения в них водорода галогеном". Теория типов Дюма предполагала наличие ряда типов органических соединений, число которых все время увеличивалось: типы спирта, альдегида, кислоты, эфира и т.п. (в принципе типы Дюма можно сопоставить с современным понятием классы органических соединений).
Вскоре после создания теории Дюма французские химики Шарль Фредерик Жерар и Огюст Лоран разработали новую теорию типов. В 1840-е годы Жерар и Лоран предложили принципиально новое понимание молекулы химического соединения как унитарной (единой) системы. Высказанное ими предположение о том, что значение электростатических сил преувеличено, вызвало резкую критику со стороны Берцелиуса и других сторонников электрохимического дуализма. Лишь в 1850-х годах (после смерти Берцелиуса) взгляды Жерара и Лорана получили признание.
Унитарная теория была изложена Жераром в небольшой книге "Введение в изучение химии по унитарной системе", опубликованной в 1848 г. Суть теории можно свести к следующему:
1. Молекула представляет собой не двойное или тройное тело – совокупность атомов либо радикалов, способных к самостоятельному существованию, но принципиально новую единую систему.
2. Вновь образованное химическое соединение следует рассматривать как полную утрату прежних свойств составившими его элементами.
3. Химическую способность атомов или групп атомов (радикалов) в молекуле можно охарактеризовать с помощью понятия функции, зависящей как от природы атома или группы атомов, так и от природы и количества других атомов (групп атомов).
В 1852 г. в работе "Об ангидридах органических кислот" Жерар сформулировал положения, составившие новую теорию типов (теорию типов Жерара-Лорана), которая на основании унитарного подхода включила и представления о сложных радикалах, и идеи Дюма о типах молекул. Согласно новой теории типов, "органические соединения могут быть сведены к трём или четырём типам; каждый из них способен давать <гомологические> ряды…; этими типами являются вода Н2О, водород Н2, хлористый водород HCl и аммиак NН3. Обменивая свой водород на определённые группы, эти типы дают начало кислотам, спиртам, эфирам, гидридам, органическим хлоридам, кетонам, щелочам". Ниже приведены формулы Жерара-Лорана для основных типов:
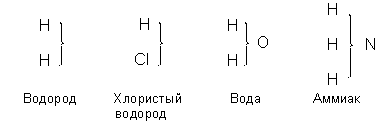
Некоторые соединения, принадлежащие к типу воды и полученные замещением водорода на соответствующие атомы или сложные радикалы, изображались в новой теории типов следующим образом:
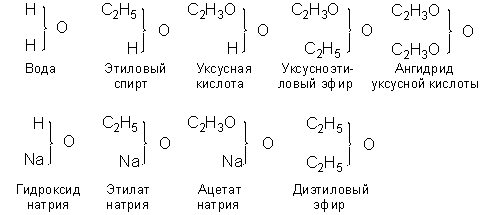
Новая теория типов завоевала в 1850-е годы широкое признание; она позволила систематизировать органические соединения, список которых очень быстро увеличивался и, что особенно важно, привела к открытию многих новых соединений (в частности, существование ангидридов карбоновых кислот было предсказано Жераром на основании данной теории). Новая теория типов развивалась трудами многих учёных: Александр Уильям Уильямсон показал, что простые эфиры можно отнести к типу воды, Шарль Адольф Вюрц исследовал амины, в которых ядром служит атом азота (тип аммиака). В 1854-1855 гг. Фридрих Август Кекуле фон Штрадониц предложил типы сероводорода и (одновременно с Уильямом Одлингом) метана (болотного газа) в качестве побочных типов; Кекуле также начал пользоваться смешанными типами, относя, например, сульфобензойную кислоту к типу воды и водорода. Российский химик Фридрих Бейльштейн опубликовал в 1880 г. обширное руководство по органическим соединениям, размещённым в рациональном порядке с использованием теории Жерара-Лорана.
Тем не менее, новая теория типов также не могла полностью удовлетворить химиков. Новая теория типов по-прежнему обходила стороной вопрос о молекулярной структуре. Жерар в рамках унитарного подхода утверждал, что формулы теории типов отражают лишь прошлое и будущее молекулы, но не её строение, которое, по его мнению, можно установить лишь физическими методами. Поэтому Жерар скептически относился к рациональным формулам теории и протестовал против утверждений, что каждому химическому соединению непременно соответствует лишь одна такая формула.
Следующим этапом развития структурной химии стала теория валентности, в известной степени представляющая собой отказ от унитарных представлений. Тем не менее, именно теория типов Жерара-Лорана подвела химиков к представлению о единицах сродства атомов и радикалов, на основе которого и была создана теория валентности.
Возникновение понятия валентности (атомности) обычно связывают с именем английского химика Эдуарда Франкленда. Франкленд, являвшийся сторонником теории сложных радикалов, изучая металлоорганические соединения, пришёл к выводу о необходимости пересмотреть теорию радикалов и признать некоторые положения теории типов. Развивая высказанные Жераром, Лораном, Одлингом, Уильямсоном и др. идеи о связи между эквивалентностью атомов и эквивалентностью радикалов, Франкленд в 1852 г. предложил ввести понятие "соединительной силы" атомов. Впрочем, хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития прежде всего потому, что он оставался приверженцем системы эквивалентов и пользовался неправильными значениями атомных масс.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. Кекуле в своей статье по-новому раскрыл теоретический смысл трёх основных типов Жерара – водорода, воды и аммиака:
"Число атомов одного элемента, связанных с одним атомом другого, зависит от основности или величины сродства. Элементы в этом отношении распадаются на три главные группы:
1. Одноосновные или одноатомные (I), например H, Cl, Br, K.
2. Двухосновные или двухатомные (II), например O, S.
3. Трёхосновные или трёхатомные (III), например N, P, As.
Отсюда вытекают три главных типа соединений: I + I, II + 2 I, III + 3 I, или же в виде простейших своих представителей HH, OH2, NH3".
Здесь же Кекуле показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является СН4 – отсюда и введённый им тип метана. В 1858 г. Кекуле развивает эти вопросы в статье "О конституции и превращениях химических соединений и о химической природе углерода". Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их свой учебник органической химии, вышедший в 1859 г.: "Самый способ прилегания отдельных атомов внутри радикалов, так же как сложение атомов в соединения, обуславливается… основностью атомов". Основность, по мнению Кекуле – фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес.
В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье "О новой химической теории" шотландец Арчибальд Скотт Купер. Однако, в отличие от Кекуле, Купер считал, что некоторые элементы способны проявлять переменную валентность: углерод характеризуется двумя степенями сродства – низшей в оксиде СО и высшей в диоксиде СО2. Купер предложил и выглядящие вполне современно (если отвлечься от удвоенного числа атомов кислорода вследствие признания за ним атомной массы, равной восьми) формулы некоторых органических соединений.
Теории Кекуле и Купера с необыкновенной лёгкостью и простотой объясняли строение и сложных радикалов, и соединений в целом. Молекула любого химического соединения рассматривалась в этих теориях как целостное образование (дань унитарному учению Жерара), которое складывается из атомов за счёт полного взаимного насыщения единиц сродства.
Теория валентности, несмотря на то, что Кекуле пришёл к ней, как к развитию теории типов Жерара-Лорана, совершенно иначе трактовала идею о целостности молекулы – лишь как неспособность её делиться на самостоятельно существующие радикалы. Иначе говоря, теория валентности поначалу представляла молекулу аддитивно – как сумму составляющих её атомов.
Однако уже три года спустя, в сентябре 1861 г. русский химик Александр Михайлович Бутлеров внёс в теорию валентности важнейшие дополнения. В докладе "О химическом строении вещества", прочитанном на Съезде немецких естествоиспытателей и врачей в Шпейере, он изложил свою теорию химического строения. Основные положения этой теории Бутлеров сформулировал таким образом:
1) "Полагая, что каждому химическому атому свойственно лишь определённое и ограниченное количество химической силы (сродства), с которой он принимает участие в образовании тела, я назвал бы химическим строением эту химическую связь, или способ взаимного соединения атомов в сложном теле";
2) "... Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением".
Оставляя открытым вопрос о предпочтительном виде формул химического строения, Бутлеров так высказался об их смысле: "... когда сделаются известными общие законы зависимости химических свойств тел от их химического строения, то подобная формула будет выражением всех этих свойств". При этом Бутлеров был убеждён, что структурные формулы не могут быть просто условным изображением молекул, а должны отражать их реальное строение. Он подчёркивал, что каждая молекула имеет вполне определённую структуру и не может совмещать несколько таких структур.
Бутлеров в своей теории проводил чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство "связывается и переходит в новую форму". Бутлеров ввёл представление о полноте использования сил сродства и о "напряжении сродства", т. е. энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное "химическое значение".
Дата добавления: 2015-04-15; просмотров: 2485;
