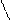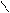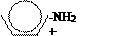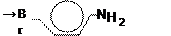Органические полимеры
Полимерами называют высокомолекулярные соединения с молекулярной массой более 5000, макромолекулы которых построены из большого числа повторяющихся одинаковых структурных звеньев. Такое звено называется элементарным звеном полимера.
Полимеры образуются из мономеров. Мономеры – это низкомолекулярные соединения, молекулы которых, взаимодействуя друг с другом, образуют полимеры. Число n, показывающее сколько раз в макромолекуле полимера повторяется структурное звено остатка мономера, называется степенью полимеризации: n=M/m, где М – молярная масса полимера; m – молярная масса элементарного звена.
Высокомолекулярные соединения (ВМС) образуются из мономеров двумя путями – полимеризацией и поликонденсацией.
Полимеризация – процесс последовательного многократного присоединения молекул непредельного мономера друг к другу по кратным связям с образованием только молекулы полимера без выделения низкомолекулярных побочных продуктов.
При этом полимер и мономер имеют один и тот же элементарный состав, но резко отличаются молярной массой. Например:
H2С=CH2 [-CH2-CH2-]n
мономер: этилен полимер: полиэтилен
Поликонденсация – процесс многократного взаимодействия низкомолекулярных веществ (мономеров) по функциональным группам с образованием как высокомолекулярного продукта (полимера), так и низкомолекулярного побочного продукта (Н2О, спирт, аммиак и др.).
Например:
n HO-CH2-CH2-OH + n HOOC-(CH2)4-COOH →
мономер: этиленгликоль мономер: адипиновая кислота
Н–[O-CH2-CH2-О-(O)C-(CH2)4-CO-]n–ОН + (2n-1) H2O
полиэфир
Таблица 4
Важнейшие реакции основных классов органических соединений и их использование в химическом анализе
| № п/п | Класс | Типичные реакции | Примеры реакций | Качественные реакции* | ||
 1 1
| Алканы | Радикальное замещение атомов водорода Окисление Расщепление | T, hn CH3- CH3 + Br2 → CH3- CH2-Br + HBr бромэтан CH4 + 2О2 → CО2 + 2H2O + Q (горение) кат CH4 + 2О2 → CН3ОН метанол Т, кат R-CH2- CH2-CH3 → R-CH3 + CH2=CH2 | * | ||
| Алкены | Присоединение Окисление Полимеризация | CH2=CH2 + Br2→ CH2Br-CH2Br CH3-CH=CH2 + HBr → CH3-CHBr-CH3 n СН2=СН2 → [-CH2-CH2-]n | * * * | |||
| Примечание: реакции, отмеченные знаком *, используются в химическом анализе органических соединений | ||||||
 |
Продолжение таблицы 4
 3 3
| Алкины | Замещение атомов водорода у тройной связи Присоединение | Ag2O + H-C≡C-H → Ag-C≡C-Ag + H2O
ацетиленид серебра
Н2O + H-C≡C-H → CH3-C=О
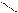 Н
ацетальдегид (этаналь)
3 H-C≡C-H → C6H6 (тримеризация)
3 H-C≡C-H → CH2=CH-C≡C-СH=CH2
дивинилацетилен Н
ацетальдегид (этаналь)
3 H-C≡C-H → C6H6 (тримеризация)
3 H-C≡C-H → CH2=CH-C≡C-СH=CH2
дивинилацетилен
| * * | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
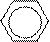
| Бензол | Электрофильное замещение атомов водорода в бензольном кольце Присоединение (с большим трудом при облучении и температуре) |
  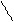 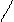 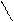 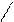    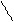 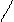 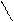 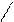
 
нитробензол
хлорбензол
| * * |
 |
Продолжение таблицы 4
 5 5
| Спирты | Замещение атомов водорода в ОН- группе на металл (кислотные свойства) Замещение группы -ОН Отщепление воды (дегидратация) | 2CH3- CH2-O-H + 2 Na → 2CH3- CH2-O-Na + H2 этилат натрия CH3- CH2-O-H + HBr → CH3- CH2-Br + H2O бромэтан CH3-CH2-OH → CH2=CH2 + H2O этилен внутримолекулярная дегидратация (Н2SO4, Т<1400) 2CH3-CH2-OH → CH3-CH2-O-CH2-CH3 + H2O диэтиловый эфир межмолекулярная дегидратация (Н2SO4, Т>1800) | * | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фенол | Замещение атомов водорода в группе –ОН на металл (кислотные свойства) Электрофильное замещение атомов водорода в бензольном кольце на другие атомы или группы атомов |
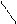



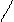 
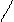 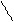
фенолят натрия
 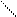 


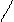 
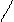 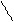
Br 2,4,6-трибромфенол (белый осадок)
| * * |

Продолжение таблицы 4
 7 7
| Карбонильные соединения (альдегиды и кетоны) | Присоединение по карбонильной группе (С=О) Окисление | 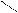 CH3-C=О +Н2 → CH3-CH2-OH – восстановление
Н
этанол
H+ CH3-C=О +Н2 → CH3-CH2-OH – восстановление
Н
этанол
H+
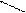 CH3-C= О + NН2-NHC6H5 → CH3-CH=NH-NHC6H5 + Н2О
H фенилгидразон
Т CH3-C= О + NН2-NHC6H5 → CH3-CH=NH-NHC6H5 + Н2О
H фенилгидразон
Т
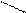 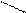 CH3-C=О + Ag2O → CH3-C=O + 2Аg
Н ОН этановая кислота
Т CH3-C=О + Ag2O → CH3-C=O + 2Аg
Н ОН этановая кислота
Т
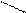 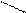 CH3-C=О + Сu(ОН)2 → CH3-C=O + Сu2О + 2 H2O
Н ОН этановая кислота CH3-C=О + Сu(ОН)2 → CH3-C=O + Сu2О + 2 H2O
Н ОН этановая кислота
| * * * | ||
| Карбоновые кислоты | Образование солей Замещение ОН- группы (этерификация) | 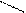  CH3-C=О + Na OH → CH3-C=O + ½ H2O
ОН ONa ацетат натрия CH3-C=О + Na OH → CH3-C=O + ½ H2O
ОН ONa ацетат натрия
ОН ОR сложный эфир | * * | |||
| Сложные эфиры | Гидролиз |   CH3-C=О + H2O → CH3-C=O + ROH
ОR ОH
этановая кислота CH3-C=О + H2O → CH3-C=O + ROH
ОR ОH
этановая кислота
 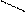 CH3-C=О + Na OH → CH3-C=O + ROH
ОR О Na ацетат натрия CH3-C=О + Na OH → CH3-C=O + ROH
ОR О Na ацетат натрия
| * |
 |
Продолжение таблицы 4
 10 10
| Амины | За счет аминогруппы За счет углеводородного радикала (электрофильное замещение в бензольном кольце) | CH3-NH2+ HCl → [CH3-NH3] .Cl (солеобразование)
Т, Н+
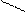 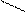 R-NH2+ CH3-C=О → CH3-C=O + H2O
←
ОН NHR
амид уксусной кислоты R-NH2+ CH3-C=О → CH3-C=O + H2O
←
ОН NHR
амид уксусной кислоты
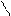 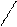 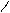 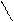  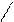  Br Br
Br 2,4,6-триброманилин (белый осадок) | * * |
 |
Литература по разделу курса химии "Строение и реакционная
способность органических соединений"
Таблица 5
| Темы | Литература, главы и разделы | |||
| [1] | [2] | [3] | [4] | |
| Классы и номенклатура органических соединений | 29.4 | § 13.1 | С. 41-45 | 2.1 |
| Строение органических соединений | 29.3 | § 2.3, § 13.1 | С. 8-24 | 2.3 |
| Изомерия органических соединений | 29.3 | § 13.1 | С. 54, 76, 266, 344 | 2.2 |
| Химические свойства и качественные реакции углеводородов | 29.5 –29.8 | § 13.2 | Гл. 1, 8, 9 | 2.4 |
| Химические свойства производных углеводородов | 29.9 – 29.17 | § 13.3 | Гл. 2, 3, 10, 11 | 2.4 |
| Полимерные вещества и направления их использования | 31.1 | § 14.1, §14.3, §14.4 | Гл. 12 –15 |
Дата добавления: 2015-04-10; просмотров: 948;

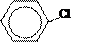

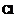



 Т, hn
Т, hn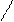
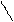
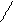
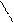 + H2 →
+ H2 →