В органических соединениях
При образовании химических связей атомные орбитали валентных электронов (2s и 2р3) атома углерода в возбужденном состоянии смешиваются между собой, выравниваясь по форме и энергии, при этом возникают гибридные атомные орбитали. Это явление называется гибридизацией орбиталей. В процессе образования связей гибридизация облегчает перекрывание электронных облаков и обеспечивает большую степень перекрывания, а следовательно, и большую прочность связей.
В зависимости от числа атомных орбиталей 2р-подуровней атома углерода, участвующих в гибридизации, различают три валентных состояния его атома (табл. 1).
Таблица 1
Характеристика гибридных орбиталей атомов углерода
| Атомные орбитали, участвующие в гибридизации | Тип гибридизации валентных орбиталей атома углерода | Общее число гибридных орбиталей и образуемых ими s-связей | Пространственная направленность гибридных орбиталей и валентные углы s-связей |
| Одна s- орбиталь и три р-орбитали | sр3 – первое валентное состояние | К вершинам правильного тетраэдра a = 109028’ | |
| Одна s- орбиталь и две р-орбитали | sр2 – второе валентное состояние | К вершинам правильного треугольника a = 1200 | |
| Одна s- орбиталь и одна р-орбиталь | sр – третье валентное состояние | Линейная, a = 1800 |
Вследствие различного типа гибридизации орбиталей атомы углерода могут формировать простые, двойные и тройные связи друг с другом и другими атомами. Гибридные орбитали образуют только s-(сигма) связи. Образование s-связей может происходить при перекрывании гибридных орбиталей, а также s- и s-, s- и p-, р-и р- атомных орбиталей или гибридных орбиталей с s- или p-орбиталями вдоль прямой, соединяющей центры атомных ядер:
В состоянии sр3-гибридизации для атома углерода характерны только одинаковые s-связи, которые направлены к вершине правильного тетраэдра.
В состоянии sр2-гибридизации атом углерода имеет три эквивалентные sр2-гибридные орбитали, которые расположены тригонально в одной плоскости.
В этом случае у атома углерода остается еще один, не участвующий в гибридизации, электрон на р-орбитали. Данная р-орбиталь перекрывается в плоскости, перпендикулярной к плоскости s-связи, с р-орбиталъю соседнего атома углерода, образуя p-(пи)-связь. Так образуется двойная связь, например, в молекуле этилена СН2=СН2. Двойная связь состоит из одной s-связи и одной p-связи (рис. 1 и 2):
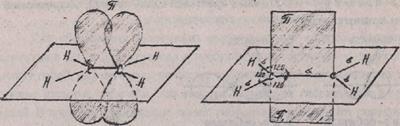
Рис. 1 Рис. 2
Расположение p-электронных Расположение плоскостей s- и p-
облаков в молекуле этилена cвязей в молекуле этилена
В состоянии sр-гибридизации атом углерода имеет две одинаковые sр-орбитали, которые ориентированы вдоль одной линии, перекрываясь они образуют линейные s-связи (a=180°), У атома углерода в sр-гибридизации остается еще два электрона на разных р-орбиталях. С помощью этих электронов атомы углерода образуют между собой две p-связи, ориентированные в двух взаимно перпендикулярных плоскостях. При этом возникает тройная связь (одна s-связь и две p-связи), как например, в молекуле ацетилена НС≡СН.
Дата добавления: 2015-04-10; просмотров: 1531;
