Моделирование системы дыхания
Моделированию системы дыхания посвящено большое число работ [Петровский Б.В. и др., 1968; Дарбинян Т.М. и др., 1969; Gray, 1945; Horgan, 1968]. Рассмотрим некоторые из этих моделей, наиболее подходящие для ИВЛ.
Одна из первых моделей дыхания — модель Грея — исследует альвеолярную вентиляцию, Ро2, Рсо2 и рН крови в ответ на вдыхание углекислого газа. Для выведения закона работы управляющей системы было принято предположение, что каждый из трех показателей химического состава крови: Ро2, Рсо2 и рН — оказывает независимый и суммарный эффект на альвеолярную вентиляцию и что эти эффекты суммируются. Используя это предположение, был эмпирически выведен закон системы регуляции дыхания в виде приведенной выше статической характеристики.
Изучение переходных процессов в системе дыхания проводилось на основе модели Гродинза (1966). В ней статические характеристики управляемой системы полагались нелинейными и описывались системой дифференциальных уравнений второго порядка.
Другой подход к моделированию системы дыхания развивается Д.М. Александером (1968), Б.В. Петровским и соавт. (1968), Л.Л. Шиком (1968). Суть его состоит в том, что при моделировании систему дыхания рассматривают не как изолированную, а во взаимосвязи с другими системами организма. Так, модель, описанная Б.В. Петровским (1968), включает в себя системы кровообращения, дыхания, тканевого обмена по нескольким веществам, систему регуляции сосудистого тонуса и др. Модель позволяет воспроизводить многие патологические эффекты, возможные в системах организма. Включенная в эту более общую модель, модель системы дыхания близка к модели [Horgan, 1968] в отношении зависимостей, определяющих концентрации кислорода и СО2 в артериальной крови, и задана системой уравнений, в которой три уравнения задают условия переноса кислорода кровью, используя кусочно-линейную аппроксимацию кривой диссоциации гемоглобина. Они учитывают распределение кровотока по различным органам. Еще два уравнения влияют на развитие материального баланса для легких.
Все рассмотренные модели системы дыхания представляют легкие, как жесткую емкость, через которую воздух протекает со скоростью, определяемой химическим составом крови. Ни в одной из моделей не сделано попытки учесть отдельные фазы дыхательного и сердечного циклов. В более простых моделях изучение динамики СО2 сводится к изучению массообмена между «резервуарами» для СО2; в более развитых моделях система дыхания является частью комплекса, охватывающего несколько систем организма. Во многих моделях влиянием О2 и рН крови на управление дыханием пренебрегают, сводя его к влиянию Рсо2, и, несмотря на это, получают удовлетворительные результаты. Некоторые важные физиологические эффекты (например, влияние Рсо2 на кривую диссоциации оксигемоглобина) не учтены ни в одной из упомянутых моделей. Индивидуальные значения физиологических констант, от которых зависит поведение модели, могут быть учтены только в результате изучения каждого конкретною организма. Последнее осложняет проверку адекватности модели и снижает ее ценность для решения задачи управления.
Главными трудностями при рассмотрении ИВЛ с точки зрения управления являются изменяемость параметров исследуемого объекта, их взаимосвязанность, а также нелинейный характер связей между переменными. При этом синтез системы автоматического управления наталкивается еще и на ограничения в выборе величины и вида управляющего воздействия, т.е. величины и скорости изменения вентиляции. В настоящее время намечаются два пути преодоления упомянутых трудностей.
Первый путь — принятие большого количества упрощающих допущений и пренебрежение некоторыми свойствами объекта, обусловленное стремлением получить модель, пригодную для реализации системы управления. В ряде задач, относящихся к биологическим объектам, это приводит к тому, что остаются неучтенными существенные свойства объекта. Поэтому системы управления, построенные на основании таких моделей, в некоторых случаях не справляются с возложенными на них задачами [Сомс М.К. и др., 1962; Frumin, 1959; Rentsch, 1966].
Второй путь — усложнение модели, обусловленное стремлением к возможно более точному учету всех связей в объекте для достижения наибольшей адекватности. Это часто приводит к тому, что синтез управления на основе полученной модели существующими средствами теории управления становится затруднительным, а в некоторых случаях и невозможным [Алсксандер Д.М. и др., 1968; Гродниз Ф.С., 1966; Horgan, 1968].
Существуют, однако, другие возможности моделирования биологического объекта, которые в явной форме не требуют выбора компромиссного решения между адекватностью модели и реализуемостью управления [Беллман Р., 1966]. Основная идея подобных методов заключается и сочетании статистических и детерминистских методов моделирования биологических объектов.
Одним из вариантов такого подхода является представление объекта линейным дифференциальным уравнением со случайными коэффициентами, заданными своими законами распределения [Бурлаков Р.П., Юшкин А.В., 1970]. Такой подход не игнорирует неизвестные свойства моделирующего объекта, в частности нелинейность и зависимость параметров объекта от неизвестных исследователю причин или от влияния одних параметров на другие. С другой стороны, на основе такой модели возможно решить задачу синтеза управления, так как в настоящее время интенсивно разрабатываются методы построения систем управления, малочувствительных к изменению в известных пределах параметров объекта [Нмельяиов В., 1967; Петров Б., 1968]. К недостаткам такого подхода следует отнести то, что модель в меньшей степени способствует пониманию свойств объекта, чем, скажем, модель, построенная по принципу усложнения уравнений.
В связи с изложенным нам представляется целесообразным при моделировании процесса ИВЛ для решения задачи управления использовать идею описания объекта линейным дифференциальным уравненном со статистически заданными коэффициентами.
Все изложенное выше в основном определило то обстоятельство, что при моделировании ИВЛ мы описывали объект линейным дифференцнальным уравнением, коэффициенты которого заданы законами распределения.
Построение такого рода полустохастнчсской модели, имея ряд преимуществ, требует наличия и обработки большого количества экспериментального материала.
Модель канала вентиляции —Рсо2при ИВЛ. Было аппроксимировано 100 кривых Iэ=Рсоз (t), полученных вэксперименте на животных, и 107 экспериментальных кривых, полученных при ИВЛ у людей во время оперативного вмешательства по различным поводам. По результатам аппроксимации были построены гистограммы для коэффициентов дифференциального уравнения.
Здесь уместно привести основные допущения, при которых модель можно считать адекватной объекту, а система управления, построенная на основании этой модели, будет обеспечивать заданное качество. Первое из этих допущений касается физиологической стороны отбора информации и предполагает соответствие (приближенное равенство) альвеолярного и артериального Рсо2. При возникновении патологии, приводящей к нарушению этого соответствия в зависимости от вида патологии, система будет поддерживать Рсо2, не соответствующее заданию, либо вообще окажется неработоспособной.
Второе допущение предполагает, что модель может отразить то изменение Рсо2, которое может быть скомпенсировано изменением минутной вентиляции. Точно так же и система управления может отработать лишь такое отклонение Pco2. которое в состоянии скомпенсировать соответствующим изменением минутной вентиляции.
Третье допущение предполагает, что за время переходного процесса изменением коэффициентов дифференциального уравнения, описывающего объект, можно пренебречь. Следует отметить, что это допущение в неявной форме предполагает кусочно-линейную линеаризацию статической характеристики объекта.
О моделировании влияния ИВЛ на гемодинамику. Поскольку условия работы системы кровообращения при ИВЛ значительно отличаются от условий самостоятельного дыхания, то при выборе режима вентиляции необходимо уменьшить, насколько это возможно, вредное влияние ИВЛ на гемодинамику пациента. С другой стороны, полученная выше модель канала вентиляция — Рсо2, давая возможность выбирать лишь величину вентиляции, оставляет произвольным способ ее задания. Приведенные выше данные о том, что система регуляции спонтанного дыхания задает способ вентиляции из условия минимума энергетических затрат на дыхание, при ИВЛ вряд ли следует использовать, так как здесь расходуется энергия внешних источников.
Применяя известные модели системы кровообращения и дыхания, Бабский Е.Б. (1947), Петровский Б.В. (1968), Гайтон А. (1969), Horgan (1968) преобразовали блок-схему объекта в такой вид, чтобы в ней были учтены полученные нами экспериментальные факты влияния ИВЛ на параметры гемодинамики (рис. 23). Блок VD отражает наличие объема мертвого пространства и в соответствии с вышеприведенным выражением преобразует общую минутную вентиляцию в альвеолярную. Блоки VD и «диффузия» характеризуют модель ИВЛ, отражающую влияние вентиляции на артериальное Рсо2.
Блок Рт отражает возникновение давления в трахее (Рт) в результате вдувания определенного дыхательного объема Vt в легкие:
Рт =К'•С•VT+ К"•R• dVT/d•t
где С и R — соответственно растяжимость грудной клетки и легких и сопротивление дыхательных путей.
Блоки «Кровоток в легких», Pnii — давление в правом предсердии и Кмк — сопротивление в малом круге кровообращения отражают влияние ИВЛ через Рт на гемодинамику.
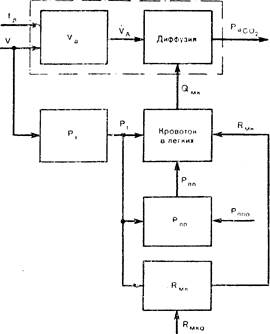
23. Блок-схема модели ИВЛ с учетом влияния режима ИВЛ на гемодннамнку. Объяснение в тексте.
Использование этой блок-схемы при синтезе системы управления ИВЛ требует прежде всего достаточного экспериментального материала для аппроксимации передаточных функций блоков конкретными зависимостями с численно заданными коэффициентами. При этом следует помнить, что необходимо выявить «критерий невмешательства в гемодинамику» пациента, что является больше медицинской, чем технической, задачей. Однако для того чтобы уменьшить отклонения параметров гемодинамики от физиологических норм, т.е. направить процесс управления ИВЛ в желаемом направлении, достаточно качественно рассмотреть предложенную модель. Ясно, что, уменьшая дыхательный объем, можно уменьшить и отклонения от физиологических норм и параметров гемодинамики. Наименьшую величину дыхательного объема в этом случае будет определять объем мертвого пространства.
Не следует забывать, что понятие мертвого пространства в физиологии дыхания не ограничивается определением какого-либо объема легких, не участвующего в газообме не. На величину Vd влияют неравномерность вентиляции по отношению к кровотоку, нарушения диффузии и др. Измерение функциональной величины Vd в условиях ИВЛ чрезвычайно затруднительно.
|
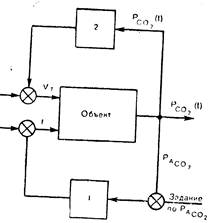
24. Блок-схема системы управления ИВЛ с учетом уменьшения вредного влияния на гемодинамику. Объяснение в тексте:
1 — контур управления частотой дыхания по Рсо2; 2 — устройство управления дыхательным объемом с анализатором формы капнограммы.
Для определения величины минимально допустимого объема дыхания при автоматически управляемой ИВЛ можно использовать капнограмму — кривую изменения концентрации СО2 во время дыхательного цикла. Известно, что наличие горизонтального участка капнограммы в конце выдоха свидетельствует о достаточном промывании мертвого пространства и, кроме того, дает информацию о значении Рсо2 в альвеолярном газе при отсутствии соответствующих патологий.
Таким образом, можно представить следующую блок-схему системы управления ИВЛ (рис. 24), уменьшающей вредное влияние ИВЛ на гемодинамику пациента. Устройство 2, анализирующее форму капнограммы Pco2 (t). дискретно уменьшает дыхательный объем, пока кривая Рсо2 имеет плато в конце выдоха и увеличивает его, если плато отсутствует, воздействуя тем самым на быстродействующий контур управления 1 частотой дыхания по Рсо2. Контур 1, отработав это возмущение, установит новое значение f, соответствующее заданному значению Рсо2, после чего устройство 2 вновь анализирует форму капнограммы. Этот процесс длится до тех пор, пока при заданном Рсо2 минутная вентиляция будет осуществляться с минимальным, но достаточным для получения значения Рсо2 дыхательным объемом и соответственно увеличенной частотой дыхания.
АВТОМАТИЧЕСКОЕ УПРАВЛЕНИЕ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИЕЙ ЛЕГКИХ С ИСПОЛЬЗОВАНИЕМ БИОЛОГИЧЕСКОЙ ИНФОРМАЦИИ
Практически все известные аппараты ИВЛ с автоматическим управлением на основе использования биологической информации построены по принципу стабилизации заданного значения Pco2. И медицинские специалисты, и инженеры являются сторонниками построения таких систем автоматического управления, которые в возможно большей степени заменяли бы утраченные по различным причинам функции систем организма, управляющих самостоятельным дыханием в нормальных условиях.
Существует по крайней мере две причины, которые затрудняют решение этой проблемы. Первая из них состоит в том, что современные знания о системе дыхания и методы автоматического управления и отбора информации для его осуществления пока не позволяют еще решать такие задачи. Вторая и главная причина состоит в том, что патологические состояния, вынуждающие переходить на искусственную вентиляцию легких, чрезвычайно разнообразны. Воздействия же, которыми создатели аппаратуры располагают при искусственной вентиляции легких, определяются величинами ряда параметров вентиляции и возможностями изменения состава газовой смеси. Поэтому и постановка задачи автоматического управления ИВЛ имеет смысл, когда имеющиеся в распоряжении методы воздействия в состоянии оказать влияние на необходимые параметры организма в нужном направлении. Другими словами, управление функциями организма во время анестезиологического и реанимационного пособия значительно шире и разнообразнее воздействий, оказываемых на организм самыми совершенными методами ИВЛ.
Несмотря на изложенное выше, проблема автоматизации процесса ИВЛ остается весьма актуальной уже потому, что ее решение снимает с врача часть сложных задач, которые ему приходится решать в ходе анестезиологических и реанимационных мероприятий.
Одна из систем управления ИВЛ по содержанию СО2 в альвеолярном или выдыхаемом газе реализована в аппарате ИВЛ РОА-1 [Сомс М.К. и др., 1962].
При проектировании этой системы авторы считали статическую характеристику пациента в рабочем диапазоне линейной:
Pco2 = f(v)
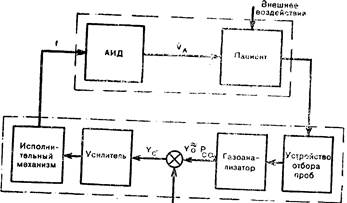
25. Блок-схема аппарата РОА-1. Объяснение в тексте.
Эта система (рис. 25) состоит из объекта управления с данной статической характеристикой управляющей системы, включающей сравнивающе-задающее устройство, усилитель, исполнительный механизм, устройство для получения пробы альвеолярного газа и оптико-акустический газоанализатор.
Величина альвеолярного Pco2, которую врач считает необходимым поддерживать у больного, задается при помощи сравнивающе-задающего устройства. Оно сравнивает сигнал задания Yi (заданное значение РAсо2) с сигналом газоанализатора Y0 (фактическое значение РAсо2) и вырабатывает сигнал ошибки: Yc, (сигнал рассогласования):
Yc=Yi-Y0
Сигнал ошибки подается на магнитный усилитель, который в зависимости от знака и величины Yc преобразовывает его в переменное напряжение с различной амплитудой и фазой. Это напряжение определяет скорость и направление вращения исполнительного механизма, который вращает элемент, задающий значение вентиляции на аппарате искусственного дыхания. В этом аппарате вентиляция регулируется путем автоматического изменения частоты дыхания, а дыхательный объем устанавливается вручную один раз на весь процесс регулирования.
Система управления аппарата РОА-1 реализует интегральный закон управления за счет применения в качестве исполнительного механизма реверсивного двигателя, управляемого магнитным усилителем, на вход которого подан сигнал рассогласования между заданной и измеряемой величинами Рсо2 в альвеолярном газе.
Так как отбор пробы артериальной крови — процедура достаточно сложная и далеко не всегда необходима во время ИВЛ, то в этом аппарате, как и в других известных системах управления ИВЛ по Рсо2 вместо Рсо2 в артериальной крови используется Рсо2 в альвеолярном газе. У больных с отсутствием патологической неравномерности распределения вентиляции относительно легочного кровотока и с отсутствием значительного артериально-венозного шунта величина альвеолярного Рсо2 находится в соответствии с величиной артериального Рсоз и ниже ее на 1 — 3 мм рт. ст. Это объясняется тем, что обмен углекислоты между кровью и альвеолами происходит очень быстро и при очень небольших градиентах напряжения СО2.
Такой прием позволяет применить в системе управления в качестве измерительного устройства обычный оптико-акустический газоанализатор, снабженный устройством отбора пробы, которое обеспечивает поступление в газоанализатор смеси из последней трети объема выдоха. При этом считается, что дыхательный объем всегда установлен врачом таким, что к моменту наступления последней трети выдоха мертвое пространство уже «промыто», и через устройство отбора проходит газ, концентрация СО2 в котором равновесна с концентрацией Рсо2 в артериальной крови. Для синтеза системы управления принята модель объекта с постоянными коэффициентами, не учитывающая возможности изменения параметров объекта. Такая возможность при ИВЛ, однако, имеется и при переходе от одного пациента к другому, и при проведении ИВЛ у одного и того же пациента, состояние которого не однозначно.
Другой системой управления ИВЛ по Рсо2 в артериальной крови является аппарат Лейпцигского научно-технического центра «Медицинмеханик» [Rentsch, 1966]. В этой системе для управления используется измерение Рсо2 в альвеолярном газе, измеряемое инфракрасным газоанализатором. В системе «Медицинмеханик» применен пневматический регулятор, реализующий пропорциональный закон управления. Модель, по которой производится синтез системы управления, как и предыдущая, не учитывала возможности изменения параметров объекта. Проверка устойчивости и выбор между обеспечением устойчивости и уменьшением величины статической ошибки регулирования производились экспериментально на модели легких.
Несмотря на то, что авторы этой разработки подчеркивали зависимость качества управления от постоянной времени и времени запаздывания у больного, от мертвого пространства аппарата и от уровня Рсо2, при построении аппарата «Медицинмеханик» эти особенности объекта не были учтены. Очевидно, что при работе с пациентом, характеристики которого могут изменяться, эта система может иметь и неудовлетворительные (например, неустойчивые) процессы регулирования.
Система автоматического управления ИВЛ по Рсо2 [Фрумин М.X., 1958; Frumin, 1959] предусматривает установку частоты дыхания вручную и снабжена интегральным регулятором, управляющим дыхательным объемом в зависимости от уровня Рсо2 в альвеолярном газе. При синтезе этой системы управления возможность изменения параметров управления объекта также не учитывалась.
Перечисленные системы построены по принципу управления интенсивностью вентиляции легких на основе использования информации о Pco2 в альвеолярном газе. Недостатком такого подхода является то, что при некоторых видах патологии (например, увеличенном венозно-артериальном шунте или ярко выраженной неравномерности легочной вентиляции по отношению к кровотоку) системы автоматического управления ИВЛ с таким отбором информации окажутся неработоспособными по причине значительного несоответствия величин альвеолярного Рсо2 и артериального Рсо2.
Работы ряда авторов [Дарбинян Т.М. и др., 1965, 1969; Чеботарь А.И., 1966; Юревнч В.М., 1966, 1967] показали, однако, что в большинстве случаев Рсо2 в пробе альвеолярного газа соответствует Рсо2 в артериальной крови и почти всегда ниже этой величины на 1 — 3 мм рт. ст. Поддержание артериального Рсо2 при ИВЛ с такой точностью вполне допустимо. Описанные системы автоматического управления ИВЛ, дающие подобную точность поддержания Рсо2 на модели легких при настройке, в ряде случаев не могли обеспечить се при работе системы аппарат — пациент. Более того, наблюдались неустойчивые или очень затянутые процессы регулирования, вследствие того, что модели, по которым производился синтез всех этих систем управления, не учитывали возможности изменений параметров объекта, влияния чистого запаздывания, ограничений управляющего воздействия, помех и др. Поэтому представляется важным, хотя бы с удовлетворительной для практики точностью, решить задачу, в которой перечисленные выше осложняющие обстоятельства учтены в комплексе. В работе А.В. Юшкниа (1970) была показана возможность подобного решения при помощи комбинирования методов нелинейного программирования и метода статистических испытаний. Преимущества такого подхода состоят в том, что трудности решения задачи синтеза системы управления, осложненной запаздыванием, помехами, ограничениями и т.п., переносятся в область вопросов сходимости алгоритмических методов поиска экстремума, точности воспроизведения объекта методами стохастического моделирования, объема памяти машины, времени решения задачи и т.д. В связи с этим при синтезе системы управления ИВЛ пришлось решать ряд вопросов, связанных с численной реализацией алгоритма, моделирующего объект управления и управляющие устройства.
Моделирование системы автоматического регулирования.Блок-схема алгоритма, осуществляющего стохастическое моделирование контура объект — регулятор и поиск параметров устройства управления, представлена на рис. 26. Алгоритм представляет собой математическую модель объекта, охваченную контуром управления с введением необходимых ограничений и запаздывания. Вся эта схема охвачена алгоритмом поиска, предназначенным для вычисления некоторого функционала качества управления с осреднением по множеству наборов параметров модели объекта и способным влиять на параметры управляющего устройства в направлении изменения функционала к его экстремальному значению.
Блок ГПЧ — генератор псевдослучайных чисел с равномерным законом распределения в диапазоне 0 — 1. Блоки T1, Т2, Т3, К, А являются фильтрами законов распределения, выдают последовательности случайных величин, т.е. коэффициенты дифференциального уравнения модели объекта при ИВЛ соответственно закону распределения каждой из них. Блок Т1/Т2 реализует дополнительную фильтрацию Т2 и T1 с целью воспроизведения корреляции между ними. Блоки W1 (р) и W2 (р) реализуют линейную часть модели ИВЛ. Все вышеуказанные блоки, кроме ГПЧ (пунктир), образуют модель канала вентиляция — Рсо2 при ИВЛ.
Блок ограничений и управляющий блок моделируют уравнения контура управления с учетом ограничений пределов и скорости изменения минутной вентиляции.
Аппарат ИВЛ с автоматическим управлением, построенный на основе моделирования. Анализ результатов испытаний модели системы управления ИВЛ позволил построить аппарат ИВЛ (рис. 27) с использованием биологической информации для управления — РОА-2.
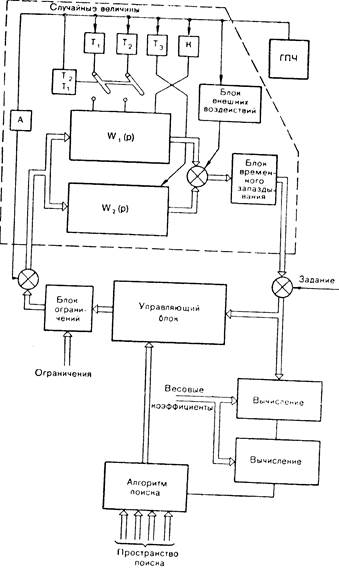
26. Блок-схема алгоритма моделирования системы управления ИВЛ. Объяснение в тексте
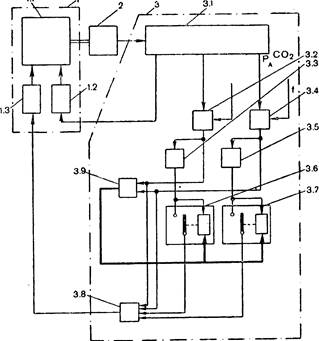
27. Блок-схема аппарата РОЛ-2. Объяснение в тексте.
Газовая смесь из блока искусственного дыхания 1 поступает в газоанализатор 2. Сигнал с выхода газоанализатора (капнограмма) поступает в цифровую часть 3.1 блока регулирования 3, где вычисляется значение парциального давления углекислоты в альвеолярном газе РАсо2, значение производной от РАсо2 и определяется наличие или отсутствие плато на каппограмме.
Контур управления дыхательным объемом 3.1, 1.2 работает следующим образом. При наличии на капнограмме плато цифровая часть блока регулирования 3.1 вырабатывает сигнал, который в течение следующего дыхательного цикла включает исполнительный механизм 1.2 в линии управления величиной дыхательного объема аппарата ИВЛ 1.1 в сторону уменьшения величины дыхательного объема; при отсутствии плато исполнительный механизм 1.2 увеличивает дыхательный объем. Таким образом, величина дыхательного объема поддерживается иа минимально допустимом уровне, достаточном, чтобы промыть мертвое пространство пациента.
Остальная часть блок-схемы (см. рис. 27) образует контур управления величиной минутной вентиляции.
Сигнал, соответствующий значению РАсо2, поступает на операционный усилитель 3.4, где сравнивается с заданным уровнем РАсо2. Рассогласование между заданным и текущим значением РАсо2; (X1), а также производная от этого рассогласования (Х2), получаемая на выходе операционного усилителя 3.2 после вычитания постоянной составляющей, используется для управления величиной минутной вентиляции в сети переменной структуры, образованной операционными усилителями 3.3 и 3.5, обеспечивающими инвертирование рассогласования X1 и производной X2; сумматорами 3.8 и 3.9; блоками знака произведения 3.6 и 3.7, обеспечивающими коммутацию сигналов инверторов 3.3 и 3.5 на вход сумматора 3.8 в зависимости от знака произведения входных сигналов на их входах.
Управляющее воздействие, получаемое на выходе операционного усилителя 3.8, отрабатывается исполнительным механизмом 1.3 в линии управления величиной минутной вентиляции блока ИВЛ.
Значения коэффициентов усиления в операционных усилителях, образующих управляемую сеть переменной структуры, выбраны таким образом, что при изменении характеристик объекта во всем диапазоне в системе возникает скользящий режим, обеспечивающий независимость качества управления величиной минутной вентиляции от характеристик объекта управления.
Опыт клинического применения аппаратов РОА-2 показал безусловную необходимость развития этого направления техники на основе углубления знаний в первую очередь о самом процессе ИВЛ, его биологических особенностях. Одновременно была реализована идея снижения влияния ИВЛ на гемодинамику за счет уменьшения дыхательного объема и повышения частоты дыхания, вызывающая в настоящее время большой интерес у клиницистов.
Дата добавления: 2015-03-09; просмотров: 2110;
