Энтропия как параметр состояния идеального газа.
Понятие энтропия было введено в науку в середине 19 века
От греческого entropia -- поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии. Функция состояния термодинамической системы...
Понятие энтропии может быть определено в качестве обобщённой координаты при тепловом воздействии на систему по аналогии с изменением объёма при механическом воздействии.
По аналогии с задачей о поршне в цилиндре
| Воздействие | Энергия воздействия | Движущая сила | Обобщенная координата |
| деформационное | dl | P | dv |
| тепловое | dq | T | ds |
Элементарная работаdl = pdv;
Элементарное теплоdq = Tds ds = dq/T; DS = S2 – S1 = 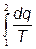
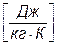 - изменение энтропии определяется как интеграл от приращения тепла, отнесённого к температуре.
- изменение энтропии определяется как интеграл от приращения тепла, отнесённого к температуре.
На основе первого закона термодинамики для идеального газа для обратимого процесса (используя уравнение Менделеева – Клайперона)
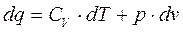
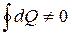 , dQ – не является полным дифференциалом.
, dQ – не является полным дифференциалом.
q – не является параметром состояния.
dq – можно представить как полный дифференциал, подобрав соответствующий интегральный множитель или делитель (Т)
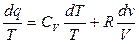 (
( 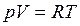 )
)
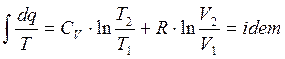
Правая часть не зависит от пути интегрирования.
Интеграл постоянный не зависит от вида процесса.
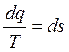 - обладает свойством полного дифференциала, а S – параметр состояния газа.
- обладает свойством полного дифференциала, а S – параметр состояния газа.
S – энтропия.
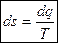 ;
; 
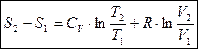
Для М, кг. газа 
Энтропия смеси газов равна сумме их энтропий при парциальном давлении каждого газа и температуре смеси.
Энтропия используется для графического исследования процессов.
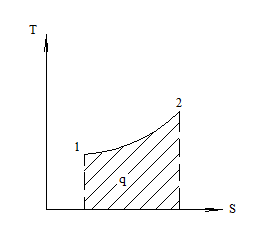
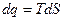 ;
; 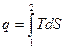
Т>0
Если 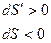 то
то 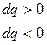
Перейдем к удельным величинам:
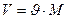 ,
, 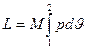
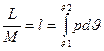
Удельная работа тоже может быть изображена в координатах 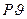 , она удобнее для термодинамических расчетов.
, она удобнее для термодинамических расчетов.
Сжатие – уменьшение удельного объема 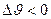
Расширение – увеличение удельного объема 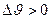
Дата добавления: 2015-02-28; просмотров: 1002;
