Теплоемкость газов.
Теплоемкостью газа называется количество тепла, которое необходимо подвести к нему в данном процессе, чтобы поднять температуру единицы количества газа на один градус.
Cp – при изобарном процессе (p=const)
Cv – при изохорном процессе (V=const)
Обычно двух теплоемкостей достаточно, но процессов в технике очень много, столько же может быть и теплоемкостей.
Cp всегда больше Cv
 - уравнение Майера.
- уравнение Майера.
В зависимости от выбранной единицы количества газа различают:
1. Массовую теплоемкость 
2. Объемную теплоемкость 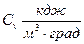
3. Мольную теплоемкость 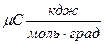
Различают истинную и среднюю теплоемкости:
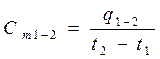 - средняя теплоемкость в процессе 1-2
- средняя теплоемкость в процессе 1-2
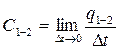 - истинная теплоемкость в процессе 1-2
- истинная теплоемкость в процессе 1-2
а) Массовая теплоемкость (Сv и Cvm; Cp и Cpm)
б) Объемная теплоемкость (С/v и C/vm; C/p и C/pm)
в) Мольная теплоемкость (mСv и mCvm; mCp и mCpm)
Зависимость между ними:
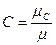
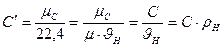
 - удельный объем газа при нормальных условиях.
- удельный объем газа при нормальных условиях.

Молекулярно-кинетическая теория вещества устанавливает следующие значения мольных теплоемкостей для идеального газа. В зависимости от атомности.
| Газ | ккал/моль град | кдж/моль град | 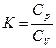
| ||
| 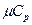
| 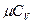
| 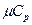
| ||
| Одноатомный Двухатомный Многоатомный | 12,6 20,9 29,3 | 20,9 29,3 37,8 | 1,67 1,40 1,29 |
К- показатель адиабаты.
Эти теплоемкости используются при грубых расчетах, т.к. теплоемкость здесь не зависит от других параметров.
В действительности теплоемкость газов зависит от температуры (а также и других параметров)

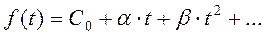 полиномная зависимость теплоёмкости от температуры
полиномная зависимость теплоёмкости от температуры
Средняя теплоемкость газа. Расчет количества подведенного тепла.

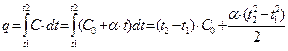

Рис. Зависимость теплоёмкости от температуры.

В справочниках обычно представлены теплоемкости от нуля градусов до t.
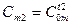 - средняя теплоемкость в интервале от 0 до t2
- средняя теплоемкость в интервале от 0 до t2
 - средняя теплоемкость в интервале от 0 до t1
- средняя теплоемкость в интервале от 0 до t1
При неточном расчете (С=const), то 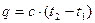
Пример.
Определить массовую теплоемкость CO2 при P=const, считая C=const.

Пример.
Дано: V=const; m=5 кг; t1=15 град. Цельсия; t2=215 град. Цельсия; С=const; O2.
Найти: q=?
Решение:
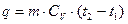
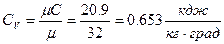
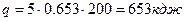
Дата добавления: 2015-02-28; просмотров: 1538;
