Каждый газ производит такое парциальное давление, какое имел бы этот газ, заполняя один весь предоставленный смеси объем.
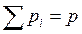 ,
,
где Pi – парциальное давление.
Для газовой смеси применимо уравнение Клайперона:
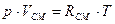
а) Смесь задана массовыми долями, каждый газ имеет массу Мi; MII; MIII и т.д.
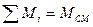
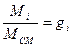 - массовая доля; i – компонент смеси.
- массовая доля; i – компонент смеси.
Газовая постоянная смеси 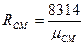 , где
, где
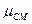 - молекулярный вес смеси.
- молекулярный вес смеси.
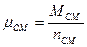 ,
,
nсм – число молей смеси.
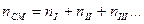
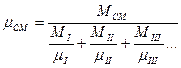
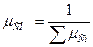
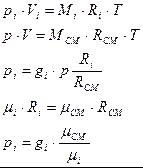
б) Смесь задана объемными долями.
Используется понятие о приведенном или парциальном объеме.
Парциальным объемом данного компонента называется объем, который занял бы этот компонент если бы он имел параметры смеси.
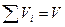 - закон Амага
- закон Амага
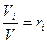 - объемная доля i – компонента.
- объемная доля i – компонента.
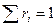
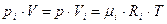
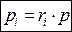
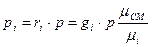
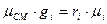
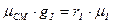
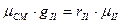 и т.д.
и т.д.
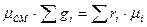
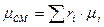
в) Смесь задана мольными долями.
ni – число молей i компонента в смеси.
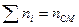
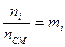 - мольная доля i компонента.
- мольная доля i компонента.
Докажем, что мольная доля численно равна объемной доле ri
По закону Авогадро при одинаковых давлениях и температурах 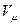 - одинаковы, поэтому объем всей смеси:
- одинаковы, поэтому объем всей смеси:
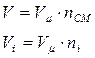
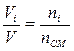
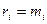
Этот случай по аналогии: 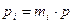 ;
; 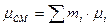
Сравним формулы парциальных давлений:
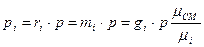 ,
,
отсюда
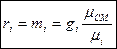
Пример 1.
Для сухого воздуха, который состоит по объему из 21% О2; 79% N2 определить газовую постоянную R; и парциальные давления Pi;
PСМ=760 мм рт. ст.
Решение:
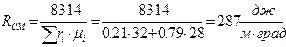
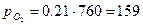 мм рт. ст.
мм рт. ст.
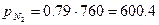 мм рт. ст.
мм рт. ст.
Пример 2.
Определить массовый мольный состав воздуха.
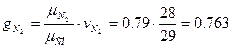
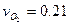
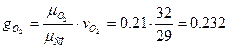
Дата добавления: 2015-02-28; просмотров: 1183;
