Развитие опухоли
Потеря контроля над процессом пролиферации. В норме процесс регуляции пролиферации осуществляется в каждой эпителиальной клетке ЖКТ. При восстановлении эпителия после перенесенной травмы или воспаления эта регуляция ослабевает, и скорость пролиферации увеличивается. После того, как количество вновь образующихся клеток сравнивается с количеством отмирающих, скорость пролиферации снижается.
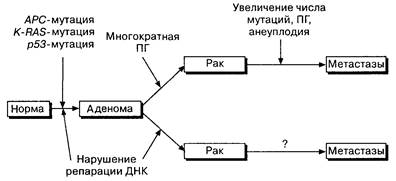
Рис.10-3. Альтернативный генетический механизм был предложен для многоэтапного канцерогенеза в толстой кишке. Все колоректальные раки накапливают мутации в АРС, K.-RAS-2, р53 локусах с нарушением функции генных продуктов. Вверху показана ситуация, когда нестабильность генома приводит к множественной ПГ. При опухолях в проксимальной части толстой кишки и при врожденном неполипозном раке толстой кишки ПГ наблюдается редко. У таких больных происходят множественные мутации ДНК, приводящие к нарушению продуктов данного гена. (По: Fearon E. R., Vogelstein В. A genetic model for colorectal tumorgenesis. Cell, 61:759,1990; Aaltonen L. A., Peltomaki P., Leach F. S., et al. Clues to the pathogenesis of familial colorectal cancer. Science 260 :812,1993; Thibodeau S. N., Bren G., Schaid D. Microsatellite instability in the cancer of the proximal colon. Science, 260: 816, 1993; lonovY., Peinado M. A., Malkhosyan S., et al. Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature, 363:558, 1993.)
Установлено, что потеря контроля над процессом пролиферации является ранней стадией канцерогенеза в толстой кишке. Это заключение было сделано на основании того, что у больных с высоким риском развития рака толстой кишки пул пролиферирующих клеток занимает все пространство от основания до верхушки крипт (в норме — только в основании крипт). Но нарушение регуляции пролиферации само по себе не может привести к развитию рака. Для этого необходимы дополнительные, пока неидентифицированные, генетические изменения, вызывающие нарушение клеточной дифференцировки, процессов старения и слущивания клеток. В состав аденомы входят гиперпролиферирующие, незрелые клетки, которые, не имея инвазивной способности, располагаются на слизистой оболочке кишки, образуя полип. Эту стадию развития проходят все опухоли толстой кишки, но она не характерна для опухолей пищевода, желудка и поджелудочной железы.
Рост доброкачественных опухолей. Небольшие аденоматозные полипы встречаются очень часто и обычно не имеют тенденции к дальнейшему росту. Однако с течением времени некоторые аденомы увеличиваются и их морфология изменяется. В желудочно-кишечном тракте гиперпролиферирующие клетки синтезируют новую ДНК под воздействием содержимого желудочно-кишечного тракта. В норме пролиферация происходит в основании крипты, поэтому вновь образующиеся клетки защищены от содержимого просвета кишечника и продуктов метаболизма бактерий. Отсутствие регуляции клеточного роста приводит к накоплению мутировавших клеток, ускорению появления повреждений эпителия и, в свою очередь, усилению клеточного роста.
Образование аденом в толстой кишке носит обратимый характер. Так, у больных с наследственным аденоматозным полипозом после субтотальной колонэктомии наблюдалось спонтанное исчезновение небольших аденом. Это — генетически детерминированное заболевание, при котором мутировавший ген находится в АРС-локусе. Это приводит к появлению большого количества полипов (аденом) либо карциномы на ранней стадии развития. У больных со множеством аденом толстой кишки возможна их регрессия на фоне приема нестероидных противовоспалительных препаратов (например, сулиндака). Механизм процесса инволюции аденом неизвестен. Уже давно установлено, что небольшие аденоматозные полипы могут исчезать без лечения. Это было подтверждено при проведении колоноскопий, но в настоящее время считается, что такие аденомы являются динамической стадией развития неоплазий толстой кишки. Клональный рост клеток может быть связан с увеличением количества факторов роста, увеличением числа клеточных рецепторов, нарушением передачи сигналов от клеточной мембраны к ядру. До сих пор не известно, при какой стадии неопластический процесс может быть остановлен, когда и как происходит регресс опухоли.
Малигнизация опухоли. Субстратом для опухолевого роста является гиперпролиферирующий пул клеток, который длительно подвергается воздействию канцерогенов окружающей среды. В тканях, предрасположенных к малигнизации, любое изменение генотипа может привести к началу роста опухоли. Как уже говорилось выше, существуют два генетических механизма образования рака. Оба этих механизма связаны с изменением гомеостаза клетки при репликации ДНК и хромосом.
Злокачественные клетки обладают способностью постоянного роста, инвазии, образования метастазов. В отличие от доброкачественных опухолевых клеток, они не могут самопроизвольно регрессировать. Постоянный рост злокачественных клеток связан с их генетической нестабильностью. Злокачественные клетки могут в процессе жизнедеятельности терять белки, что приводит к их гибели. Этим обусловлено появление многочисленных очажков некроза в опухолях. В процессе дальнейших генетических перестроек в опухоли могут возникать другие, более жизнеспособные клетки, которые постепенно замещают строму опухоли. Вследствие выраженной фенотипической нестабильности злокачественных клеток среди них постоянно происходит отбор по способности роста, инвазии, распространения.
Метастазы. Метастазирование опухолевых клеток происходит не случайно. Для этого клетки должны повредить базальную мембрану и другие окружающие их соединительные структуры. Далее клетки проникают в кровеносные и лимфатические сосуды, по ним мигрируют по организму, преодолевая действие его защитных сил. В месте будущего метастаза клетки накапливаются, выходят из сосуда и начинают разрастаться. Для осуществления этого в клетках должно произойти множество генетических изменений. Поэтому метастазы появляются на поздних стадиях развития заболевания.
Для роста опухолевым клеткам необходимо постоянное кровоснабжение. Кислород может примерно на 100-400 нм проникать из сосуда в ткани, т. е. на диаметр 4—10 клеток (в зависимости от их типа). Опухоли способствуют росту и появлению новых капилляров (неоваскуляризация), что позволяет им выживать при метастазировании. Этот опухолевый ангиогенез стимулируется различными факторами роста, например действием фактора опухолевого ангиогенеза. Место метастазирования может быть случайным, зависящим лишь от кровоснабжения органа. В некоторых органах имеются специфические клеточные рецепторы, способствующие развитию опухолевых клеток.
Генетические основы метастазирования еще до конца не изучены. Обнаружен ген, который присутствует в отдаленных метастазах при определенных видах рака. Ген NM23, вероятно, является супрессором метастазов и поэтому практически всегда отсутствует в отдаленных метастазах при раке толстой кишки. Клеточный механизм действия гена NM23 не известен. Скорее всего в образовании метастатического фенотипа участвует много генов, их накопление в малигнизированных клетках лежит в основе процесса диссеминации, наблюдаемом при опухолях различного происхождения.
Дата добавления: 2015-02-23; просмотров: 786;
