Работа 3. Биогенными элементами называют химические элементы, постоянно входящие в состав организмов и выполняющие определенные функции (O
Биогенные вещества
Биогенными элементами называют химические элементы, постоянно входящие в состав организмов и выполняющие определенные функции (O, C, H, N, P, S). В группу биогенных элементов кроме вышеперечисленных часто включают железо, поскольку оно необходимо живым организмам, а его содержание в некоторых случаях достигает нескольких мг/л воды.
Азот – важнейший элемент питания, необходимый для нормального развития растений. Он входит в состав белков, нуклеиновых кислот, гемоглобина. Соединения азота играют большую роль в процессах фотосинтеза, обмене веществ, образования новых клеток. Вместе с тем в современную эпоху заметно усилился процесс обогащения окружающей среды соединениями азота. О значительном загрязнении соединениями азота свидетельствует повышение уровня концентрации нитратов в природных водах в 2 – 4 раза и более. Негативным фактором в этом процессе является повышение концентрации аммонийного и нитратного азота до токсичных уровней.
Железо – непременный компонент поверхностных вод. Кроме растворенного ионного железа в природных водах присутствуют гидроксокомплексы, коллоидные неорганические и органические формы. В природных водах многие соединения железа малоустойчивы, поскольку подвергаются гидролизу с последующим осаждением гидроксидов. Избыточное количество железа приводит к заболеванию кровеносной системы и циррозу печени. Предельно допустимая концентрация ионов железа в воде составляет 0,5 мг/л.
Поступление в организм избыточного количества нитратов (более 10 мг/кг массы тела) вызывает развитие метгемоглобинемии и, как следствие, недостаточное обеспечение организма кислородом. Нарушаются многие обменные процессы в организме, снижается иммунитет, нарушается деятельность эндокринных органов и т. д.
Допустимая суточная доза потребления человеком нитратов в России принята равной 300 – 325 мг (т. е. 5 мг на кг его массы). Реальная суточная нагрузка, по экспертным оценкам, колеблется от 150 до 360 мг. Она значительно меняется в зависимости от характера питания и содержания нитратов в воде и достигает в ряде случаев 500 – 600 мг/сут на человека.
Цель работы: определить содержание ионов аммония (NH4+), нитрит-ионов (NO2-), нитрат-ионов (NO3-) и ионов железа (Fe3+) в исследуемой воде.
Материалы, реактивы, оборудование: штатив с пробирками; мерные колбы на 25 мл, 50 мл, 100 мл; пипетки на 1 мл, 5 мл, 10 мл с делениями; стакан на 150 мл; предметное стекло; исследуемая вода; раствор сегнетовой соли КNaC4H4O6  4H2O; реактив Несслера KHgI4; безаммиачная вода; стандартные растворы хлорида аммония NH4Cl (прил. 2); крахмальная бумага; 2 н. раствор уксусной кислоты СН3СООН; 0,1 н. раствор иодида калия KI; 10%-ый раствор реактива Грисса; гидроксид аммония, суспензия для коагуляции; активированный уголь; стандартные растворы нитрита натрия NaNO2 (прил. 2); 0,1 М раствор гексацианоферрата (III) калия К3[Fe(СN)6]; 50%-ый раствор роданида аммония NH4CNS или роданида калия KCNS; кристаллический персульфат аммония (NH4)2S2O8; раствор соляной кислоты HCl (пл. 1,19 г/см3); стандартные растворы железа (прил. 2); 10%-ый раствор аммиака. фотоколориметр; электроплитка.
4H2O; реактив Несслера KHgI4; безаммиачная вода; стандартные растворы хлорида аммония NH4Cl (прил. 2); крахмальная бумага; 2 н. раствор уксусной кислоты СН3СООН; 0,1 н. раствор иодида калия KI; 10%-ый раствор реактива Грисса; гидроксид аммония, суспензия для коагуляции; активированный уголь; стандартные растворы нитрита натрия NaNO2 (прил. 2); 0,1 М раствор гексацианоферрата (III) калия К3[Fe(СN)6]; 50%-ый раствор роданида аммония NH4CNS или роданида калия KCNS; кристаллический персульфат аммония (NH4)2S2O8; раствор соляной кислоты HCl (пл. 1,19 г/см3); стандартные растворы железа (прил. 2); 10%-ый раствор аммиака. фотоколориметр; электроплитка.
3.1. Определение ионов аммония
3.1.1. Качественное определение ионов аммония
В пробирку наливают 10 мл исследуемой воды, прибавляют 0,2 – 0,3 мл сегнетовой соли и 0,2 мл реактива Несслера. Через 10 – 15 мин проводят приближенное определение ионов аммония по табл. 6.
3.1.2. Количественное определение ионов аммония
Ионы аммония определяют фотометрически по реакции с реактивом Несслера. Принцип метода основан на том, что аммоний с реактивом Несслера образует йодид меркураммония, который окрашивает раствор в желто-коричневый цвет. Интенсивность окраски пропорциональна содержанию аммония в воде.
NH4+ + 2K2HgI4 + 2KOH 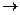 NH2Hg2I3
NH2Hg2I3 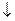 + 5KI + 2H2O + K+
+ 5KI + 2H2O + K+
Так как соли кальция и магния, обычно содержащиеся в природных водах, при взаимодействии с реактивом Несслера могут выпасть в осадок, их связывают раствором виннокислого натрия-калия (сегнетовой солью). Диапазон определяемых концентраций аммония – 0,05 – 4 мг/л.
Таблица 6
Ориентировочное содержание аммиака и ионов аммония
| Окрашивание при рассматривании | Аммиак и ионы аммония | ||
| сбоку | сверху | мг N/л | мг NH4+/л |
| Нет Нет Чрезвычайно слабое желтоватое Очень слабое желтоватое Слабо-желтоватое Светло-желтое Желтое Мутноватое, резко-желтое Интенсивно-бурое, раствор мутный | Нет Чрезвычайно слабое желтоватое Слабо-желтоватое Желтоватое Светло-желтое Желтое Буровато-желтое Бурое, раствор мутный Бурое, раствор мутный | < 0,04 0,08 0,2 0,4 0,8 2,0 4,0 8,0 >10,0 | < 0,05 0,1 0,3 0,5 1,0 2,5 5,0 10,0 > 10,0 |
Как правило, в чистых природных водах содержится
0,01–0,1 мг/л аммонийных солей. Предельно допустимые концентрации аммиака в воде водоемов 2 мг/л (по азоту).
К 50 мл пробы воды приливают 1 мл сегнетовой соли и 1 мл реактива Несслера, перемешивают. Через 10 мин измеряют оптическую плотность раствора в кюветах с толщиной оптического слоя 2 – 5 см, в зависимости от концентрации аммиака, с фиолетовым светофильтром ( 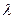 425 нм) по отношению к безаммиачной воде, в которую добавлены соответствующие реактивы. Содержание ионов аммония (мг) находят по калибровочному графику или визуально, сравнивая интенсивность окраски пробы и шкалы стандартных растворов, приготовленных одновременно.
425 нм) по отношению к безаммиачной воде, в которую добавлены соответствующие реактивы. Содержание ионов аммония (мг) находят по калибровочному графику или визуально, сравнивая интенсивность окраски пробы и шкалы стандартных растворов, приготовленных одновременно.
Построение калибровочного графика. В мерные колбы на 50 мл вносят 0 – 0,1 – 0,2 – 0,5 – 1 – 1,5 – 2 – 3 мл рабочего стандартного раствора NH4Cl, что соответствует содержанию 0 – 0,005 – 0,01 – 0,025 – 0,05 – 0,075 – 0,10 – 0,15 мг NH4+. Доводят до метки безаммиачной водой, перемешивают и прибавляют реактивы как при анализе пробы, фотометрируют через 10 мин после прибавления реактива Несслера. Калибровочный график строят в координатах оптическая плотность – содержание ионов NH4+ (мг).
Концентрацию ионов аммония (мг NH4+/л) рассчитывают по формуле:
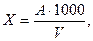
где А – содержание ионов NH4+, найденное по калибровочному графику, мг; V – объем пробы, взятой для анализа, мл.
Для выражения результатов в форме аммонийного азота (мг N/л) полученную величину (мг NH4+/л) умножают на коэффициент 0,77.
Дата добавления: 2015-02-23; просмотров: 1261;
