Определение общей жесткости
Для определения общей жесткости пользуются трилонометрическим методом. Основным рабочим раствором является трилон Б – двунатриевая соль этилендиаминтетрауксусной кислоты:

 COOH-CH2 CH2-COONa
COOH-CH2 CH2-COONa

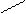 N-CH2-CH2-N
N-CH2-CH2-N
COOH-CH2 CH2-COONa
Определение суммарного содержания ионов кальция и магния основано на способности трилона Б образовывать с этими ионами прочные комплексные соединения в щелочной среде, замещая свободные ионы водорода на катионы Са2+ и Mg2+
Ca2+ + Na2H2R 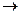 Na2CaR + 2H+,
Na2CaR + 2H+,
где R – радикал этилендиаминтетрауксусной кислоты. В качестве индикатора используется хромоген черный, дающий с Mg2+ соединение винно-красного цвета, при исчезновении Mg2+ он приобретает голубую окраску.
Реакция идет при рН 10, что достигается добавлением в пробу аммиачного буферного раствор (NH4OH+NH4CI). В первую очередь связываются ионы кальция, а затем магния.
Определению мешают ионы меди (>0,002 мг/л), марганца (>0,05 мг/л), железа (>1,0 мг/л), алюминия (>2,0 мг/л).
Материалы, реактивы, оборудование:бюретка; пипетки на 15 мл, 100 мл; колба коническая на 250 мл; капельница; мерный цилиндр на 100 мл; 0,05 н. раствора трилона Б; 0,05 н. раствор сульфата магния MgSO4; аммиачный буферный раствор NH4OH + NH4CI; индикатор хромоген черный;исследуемая вода.
Определение нормальности трилона Б производится по стандартному 0,05 н. раствору MgSO4.
В коническую колбу отмеряют пипеткой 15 мл 0,05 н раствора MgSO4, добавляют 85 мл дистиллированной воды (до 100 мл мерным цилиндром), приливают 5 мл аммиачного буферного раствора и 5 капель индикатора хромогена черного, после чего проводят титрование раствором трилона Б.
Пробу титруют до появления голубой окраски от одной прилитой капли трилона Б, что свидетельствует об исчезновении ионов Mg2+.
Дальнейшее прибавление трилона Б не изменяет голубой окраски раствора, поэтому следует внимательно следить за постепенным изменением окраски от винно-красной через переходные окраски (фиолетовую, грязно-синюю) до голубой.
Титрование проводят дважды. Поправочный коэффициент к нормальности трилона Б рассчитывают по формуле:
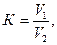
где V1 – количество трилона Б, израсходованное на титрование, мл; К – поправочный коэффициент к нормальности трилона Б; V2 – объем пробы, мл.
Определение общей жесткости пробы. Пипеткой Мора отмеряют 100 мл исследуемой воды в коническую колбу, добавляют буферный раствор и индикатор (в том же количестве, что и при определении поправочного коэффициента), и титруют раствором трилона Б. Определение повторяют и берут средний результат.
Вычисление общей жесткости в мг-экв/л проводят по формуле:
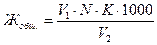 ,
,
где V1 – количество трилона Б, израсходованное на титрование, мл; К – поправочный коэффициент к нормальности трилона Б; V2 – объем пробы, мл; N – нормальность трилона Б.
2.6.3. Определение перманганатной окисляемости
Под окисляемостью воды понимают количество кислорода, искусственно введенного окислителя (например, КМпО4 или К2Сr2О7), идущее на окисление содержащихся в воде органических веществ. Различают перманганатную (КМпО4) и бихроматную (К2Сr2О7) окисляемость.
Кроме органических веществ могут окисляться некоторые неорганические восстановители, например, NO2-, Fe2+, Мп2+, H2S и др. При значительном содержании восстановителей их влияние на величину окисляемости учитывается при расчете.
Происхождение и содержание органических веществ, находящихся в природных водах, весьма разнообразно. Различны и их химические свойства по отношению к кислороду: одни вещества устойчивы к окислению, другие, наоборот, легко окисляются. Прямое определение органических веществ в природных водах является сложной и трудоемкой задачей. Поэтому пользуются более простыми косвенными методами. Один из них – это метод перманганатной окисляемости, дающий представление о содержании в воде легко окисляющихся органических веществ. Метод бихроматной окисляемости соответствует полному окислению органических веществ (легко и трудно окисляющихся), за исключением некоторых белковых соединений. Обычно перманганатная окисляемость, составляет 40 – 50% от истинной окисляемости органических веществ.
Повышенная окисляемость может указывать на загрязнение воды. Наименьшую окисляемость (до 1–2 мг О2/л) имеют глубокие подземные воды, относящиеся к 1-му классу. Окисляемость подземных вод, относящихся ко 2-му и 3-му классам, может быть повышена, но не более 5 и 15 мг О2/л соответственно. В грунтовых водах окисляемость обычно выше (до 2 – 4 мг O2/л). В воде открытых водоемов окисляемость повышается до 5 – 6 мг O2/л в реках и до 6 – 8 мг O2/л в водохранилищах, достигая еще больших величин в водах болотного происхождения. Вода считается пригодной для хозяйственных и питьевых целей, если перманганатная окисляемость ее не превышает 3,0 мг О2/л.
Установлено, что с повышением содержания в воде органических веществ увеличивается и ее бактериальное загрязнение.
Определение основано на том, что КМпО4, будучи в кислой среде сильным окислителем, реагирует с присутствующими в воде восстановителями (органические вещества, соли железа (II), нитриты). Ион МпО4- принимает при этом 5 электронов и переходит в двухвалентный катион Мп2+ по уравнению:
MnO4- + 8H+ + 5 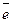
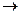 Mn2+ + 4H2O
Mn2+ + 4H2O
Избыток КМпО4- реагирует с вводимой в раствор щавелевой кислотой:
2MnO4- + 5H2C2O4 + 6H+ 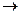 2Mn2+ + 10CO2 + 8H2O
2Mn2+ + 10CO2 + 8H2O
Не вступившая в реакцию щавелевая кислота оттитровывается КМпО4 по приведенному уравнению.
Точность метода 0,4 мг О2/л, если окисляемость не превышает 4 мг О2/л,при более высокой окисляемости – 10 %.
Материалы, реактивы, оборудование:бюретка для титрования; пипетки на 10 мл, 15 мл, 50 мл, 100 мл;колба коническая термостойкая на 250 мл; электроплитка; стеклянная воронка; 0,01 н. раствор перманганата калия КМпО4;0,01 н. раствор щавелевой кислоты H2C2O4; 1:3 раствор серной кислоты H2SO4, предварительно ее окисляют на холоде раствором KMnO4 до слабо-розовой окраски для удаления возможных восстановителей; исследуемая вода.
В колбу отмеряют пипеткой 100 мл (или меньше) исследуемой пробы в зависимости от содержания в ней органических веществ (при окисляемости до 10 мг O2/л можно брать 100 мл пробы). При объеме пробы меньше 100 мл доводят общий объем до 100 мл дистиллированной водой. В колбу приливают 5 мл H2SO4 (1:3) и 15 мл 0,01 н. раствора КМпО4.. Нагревают пробу до кипения, и кипятят 10 мин. с начала появления первых пузырьков. Во избежание разбрызгивания содержимого колбы при нагревании необходимо в горло колбы вставить стеклянную воронку.
В процессе кипячения могут произойти следующие изменения первоначального фиолетового цвета раствора перманганата:
1) жидкость обесцвечивается, что свидетельствует о большом содержании в данном объеме пробы восстанавливающих веществ. В таком случае определение повторяют и берут меньший объем исследуемой пробы;
2) жидкость приобретает коричнево-бурый цвет, что свидетельствует о недостаточном количестве H2SO4. В таком случае в раствор следует добавить еще 5 мл H2SO4 и продолжить определение;
3) жидкость приобретает красноватый оттенок или остается после 10 минутного кипячения окрашенной в фиолетовый цвет. Это свидетельствует о том, что определение идет правильно.
В горячий раствор приливают пипеткой 15 мл 0,01 н. раствора Н2С2О4 (количество раствора должно строго соответствовать первоначальному объему КМпО4, добавленному в пробу при кипячении). Содержимое колбы при этом обесцвечивается, Н2С2О4 окисляется атомарным кислородом, который образуется при распаде КМпО4. Так как частично КМпО4 расходуется на окисление органических веществ в исследуемой пробе, при добавлении в пробу 15 мл раствора Н2С2О4 создается ее избыток. Не доливая бюретки с раствором КМпО4 титруют пробу до появления устойчивой слабо-розовой окраски от одной прибавленной капли КМпО4. Записывают суммарное количество КМпО4, израсходованное как на окисление органических веществ в пробе, так и на окисление 15 мл Н2С2О4 (обозначим его через А).
Определение нормальности КМпО4: для определения поправочного коэффициента к нормальности КМпО4, затраченного на окисление 15 мл Н2С2О4 (обозначим его как В), в колбу, в которой производился анализ, приливают пипеткой 15 мл стандартного 0,01 н. раствора Н2С2О4 (в зависимости от первоначально прилитого объема КМпО4) и пробу титруют вновь до слабо-розовой окраски (температура пробы при титровании должна быть 50 – 600С).
Поправочный коэффициент к нормальности КМпО4 вычисляют по формуле:
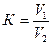 ,
,
где V1 – объем H2C2O4, мл; V2 – объем KMnO4, мл.
Вычисление результатов в (Х, мг О2/л) производят по формуле:
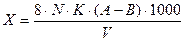 ,
,
где 8 – эквивалентная масса кислорода; К – поправочный коэффициент к нормальности КМпО4; N – нормальность раствора КМпО4 (0,01 н.); А – количество КМпО4, затраченное на окисление органических веществ и 15 мл Н2С2О4, мл; В – количество КМпО4, израсходованное на окисление 15 мл Н2С2О4, мл; V – объем пробы воды, взятой для анализа, мл.
Результаты химического анализа воды занесите в табл. 4. Проанализируйте полученные результаты и сделайте вывод о возможности применения исследуемой воды.
Дата добавления: 2015-02-23; просмотров: 2049;
