Билет 14
1.Кинетические явления (явления переноса) это необратимые процессы, сопровождающиеся переносом какой-либо физической величины, в результате стремления любой системы перейти из неравновесного состояния в равновесное состояние.
Кинетические явления в молекулярной физике: вязкость, теплопроводность, диффузия.
Для оцінення швидкості руху молекул вводиться поняття середньої довжини шляху, який молекула проходить без зіткнень . Для підрахунку цього шляху беруть суму довжин відрізків траєкторії l1, l2, l3,..., ln від зіткнення до зіткнення і цей загальний шлях ділять на кількість відрізків п, яка дорівнює кількості зіткнень, тобто

За цією формулою визначають середній шлях, який молекула проходить вільно від зіткнення до зіткнення і який називається середньою довжиною вільного пробігу молекул.
Для визначення визначимо спочатку кількість зіткнень обраної молекули з іншими молекулами за одиницю часу.
Справді, за одиницю часу молекула проходить відстань, що дорівнює значенню середньої швидкості руху молекул газу . Тому об’єм циліндра, в якому містяться задані молекули, буде 4πr2.
Якщо концентрація молекул становить n0, то всередині заданого циліндра міститься число молекул, яке дорівнює z = 4πr2n0. Це число z і визначає середню кількість зіткнень за одиницю часу. Оскільки інші молекули також перебувають у русі, то в це число вводять поправочний множник, що дорівнює 2. Тому середню кількість зіткнень за одиницю часу визначають за формулою

Щоб визначити середню довжину вільного пробігу молекул, потрібно шлях, який проходить молекула за одиницю часу (чисельно він дорівнює ), поділити на кількість відповідних відрізків шляху, тобто на середню кількість зіткнень z за одиницю часу:=z або
 Отже, середня довжина вільного пробігу не залежить від температури газу, оскільки з підвищенням Т одночасно збільшуватиметься i z.
Отже, середня довжина вільного пробігу не залежить від температури газу, оскільки з підвищенням Т одночасно збільшуватиметься i z.
2.Якщо термодинамічна система адіабатно ізольована, то 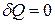 , і зміна ентропії у результаті протікання оборотних процесів
, і зміна ентропії у результаті протікання оборотних процесів 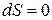 , а під час необоротних процесів, які, власне, тільки і існують у природі, як показує досвід і теорія, ентропія зростає.
, а під час необоротних процесів, які, власне, тільки і існують у природі, як показує досвід і теорія, ентропія зростає.
Тут немає суперечності. Рівність 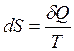 має місце лише для оборотних процесів за означенням ентропії. Для необоротних процесів ентропія буде збільшуватись навіть у адіабатній системі.
має місце лише для оборотних процесів за означенням ентропії. Для необоротних процесів ентропія буде збільшуватись навіть у адіабатній системі.
Властивість зростати притаманна ентропії так само, як енергії – зберігатись. Закон зростання ентропії виражає друге начало термодинаміки для необоротних процесів, тобто
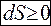 , або
, або 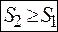 .
.
Ентропія адіабатно ізольованої системи не може зменшуватись; вона або збільшується, або лишається сталою. Це – закон зростання ентропії встановлений Клаузіусом.
Для оборотного процесу ми можемо записати зміну ентропії. Тіло 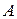 втрачає кількість теплоти
втрачає кількість теплоти 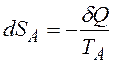 ,а тіло
,а тіло 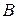 отримує теплоту.
отримує теплоту. 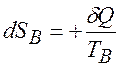
Ентропія є адитивною величиною, тому 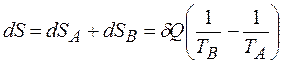 .
.
За законом збільшення ентропії процеси можуть йти тільки у напрямку збільшення ентропії (принаймні не зменшення), тому із нерівності
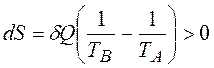 випливає, що вона може виконуватись лише при
випливає, що вона може виконуватись лише при
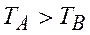 .
.
Отже, ми отримали, що тепло завжди буде йти у напрямку від більш нагрітого тіла до менш нагрітого, і це буде супроводжуватись збільшенням ентропії.
Дата добавления: 2015-01-13; просмотров: 985;
