Билет 13
1) В изолированной системе возможны только такие процессы, при которых энтропия системы возрастает. Т.е. dS≥ 0 или dS≥ dQ/T .
Второе начало термодинамики определяет направление термодинамических процессов и указывает на физический смысл энтропии: энтропия - мера рассеяния энергии, т.е. характеризует ту часть энергии, которую нельзя превратить в работу.
Принцип Tомсона - процесс, при котором работа переходит в тепло без количественных изменений состояния системы, необратим, т.е. невозможно полностью преобразовать в работу всё тепло, взятое от тела, не производя никаких др. изменений состояния системы.
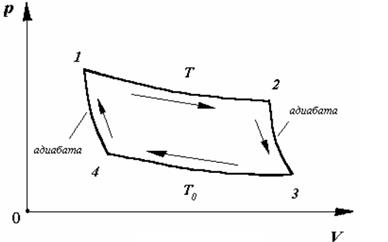
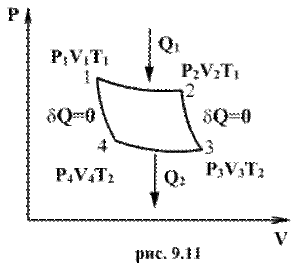
Наиболее совершенным в отношении КПД является цикл Карно, который состоит из двух изотерм (1-2, 3-4) и двух адиабат (2-3, 4-1).
При изотермическом расширении от нагревателя отбирается тепло Q1 (на участке 1-2). Вследствие этого температура газа поддерживается неизменной. Соответственно, параметры точки 2 будут равны P2V2T1. На участке 2-3 происходит адиабатное расширение. Внутренняя энергия газа уменьшается и его температура падает до T2. Параметры точки 3 – P3V3T2 . На участке 3-4 газ изотермически сжимается. Параметры точки 4 - P4V4T2. Выделяющееся при этом тепло Q2 отбирается холодильником. Участок 4-1 -адиабатическое сжатие до исходного состояния, соответствующего точке 1. Таким образом, завершен цикл “1-2-3-4-1 и в итоге нагреватель отдал газу теплоту Q1 , а холодильник отобрал Q2 . Разность Q1 - Q2 определяет полезную работу газа за один цикл, так как согласно I началу термодинамики бQ =бA + dU , но для кругового процесса dU=0 и, следовательно бQ=бA.
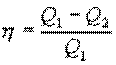 Определим коэффициент полезного действия цикла Карно для обратимого процесса. Теплота подводится на участке 1-2 и отводится на участке 3-4. Для изотермического процесса внутренняя энергия Q=const и все подводимое тепло расходуется на работу Q1.= A.
Определим коэффициент полезного действия цикла Карно для обратимого процесса. Теплота подводится на участке 1-2 и отводится на участке 3-4. Для изотермического процесса внутренняя энергия Q=const и все подводимое тепло расходуется на работу Q1.= A.
Тогда
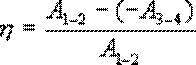 или
или 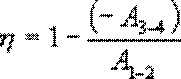
Для изотермического процесса работа
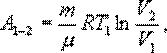
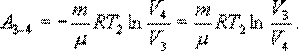
С учетом последних выражений
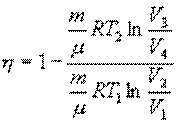 Покажем, что
Покажем, что 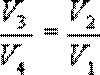
Так как процессы на участках 2-3 и 1-4 адиабатические, для определения связи между V3 и V2 и V2 и V4 используем уравнение Пуассона в виде  Следовательно,
Следовательно, 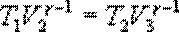 и
и 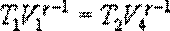
Разделим эти уравнения и получим 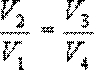
Тогда выражение для к.п.д. (9.24) примет вид 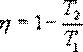
Эта формула справедлива только для обратимого цикла Карно.
2.
Энтропия системы физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс. Энтропия, подобно внутренней энергии, является однозначной функцией состояния системы.
Бесконечно малое изменение энтропии определяется соотноше-
нием dS=dQ/T
При переходе системы из одного состояния в другое, изменение эн-
тропии можно рассчитать так
S=S2-S1=12dQ/dT
На основании первого начала термодинамики
dQ=dU+dA=CvdT+pdV=CvdT+RT/V*dV
тогда
dQ/T=Cv*dT/T+R*dV/V
S=S2-S1=T1T2V1V2dQ/dT=Cv*lnT2/T1+R*lnV2/V1
Известно, что при изотермическом процессе T = const, т.е. T1=T2,
тогда S= R*lnV2/V1
Пр изохориическом процессе V = const, т.е. V2 = V1. Таким образом
S=Cv*lnT2/T1
Дата добавления: 2015-01-13; просмотров: 1065;
