Парообразование жидкостей
3.1.1. Особенности фазовых переходов
Во многих технических системах нашли широкое распространение рабочие тела в виде пара различных веществ: воды, аммиака, углекислоты, фреона. Кроме того, часто используются как газообразные, так и сжиженные кислород, азот и др. газы. Как получение пара из жидкости, так и получение жидкого вещества из газа осуществляется в результате фазовых переходов. Известны четыре агрегатных состояний вещества: твердая, жидкая, газообразная фазы и плазма. Каждая фаза представляет собой однородную систему с одинаковыми физическими свойствами во всех ее частях. Характерной особенностью агрегатного состояния вещетва является наличие гранниц, отделяющих данную фазу от соприкасающихся с нею других фаз. При определенных условиях вещество может переходить из одной фазы в другую.
Процесс перехода вещества из твердой фазы в жидкую носит название п л а в л е н и я. Обратный переход именуют к р и с т а л- л и з а ц и е й.
В некоторых условиях твердое вещество может переходить сразу в газообразную фазу, минуя жидкое состояние.
Процесс перехода твердой фазы в газообразную называют с у б л и - м а ц ие й, а обратный процесс – д е с у б л и м а ц и е й.
Процесс перехода вещества из жидкого состояния в газообразное именуют п а р о о б р а з о в а н и е м, из газообразного в жидкое –
к о н д е н с а ц и е й.
Различают фазовые переходы 1-го и 2-го родов.
К фазовым переходам 1-го рода относят превращения, сопровождающиеся поглощением или выделением теплоты r и скачкообразным изменением удельного объема v , т.е. dq 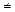 0 ; r
0 ; r 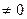 и dv
и dv 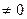 . К фазовым переходам 2-го рода относят превращения при dq=0 и dv=0. В этом случае происходит скачкообразное изменение теплоемкости.
. К фазовым переходам 2-го рода относят превращения при dq=0 и dv=0. В этом случае происходит скачкообразное изменение теплоемкости.
В теплоэнергетических установках чаще используются вещества, которым присущи фазовые переходы 1-го рода.
Граница между двумя фазами при любых фазовых переходах представляет собой поверхность равновесия фаз, на которой градиенты давлений и температур равны нулю. Пересечение поверхности равновесия плоскостью, соответствующей фиксированному значению одного из параметров состояния, дает кривую равновесия, изображенную в координатах других параметров. Так, например, кривые равновесия воды можно представить в координатах pT в виде уравнения:
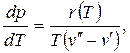 (3.1)
(3.1)
где 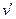 и
и 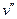 – удельные объемы вещества в начале и конце фазового перехода соответственно;
– удельные объемы вещества в начале и конце фазового перехода соответственно;
r- теплота фазового перехода.
Начало координат задается таким, что на поле pT - диаграммы можно разместить состояния твердой, жидкой и газообразной фаз какого-либо вещества.
Равновесное состояние этого вещества, а также равновесные состояния фазовых переходов изображаются точками.
Точка, в которой находятся в равновесном состоянии три фазы однородного вещества, называется т р о й н о й т о ч к о й.
Тройная точка является началом кривых функций p=f(T) для фазовых переходов: твердое вещество – жидкость, жидкость – пар, твердое вещество - пар. Характер этих кривых определяется выражением (3.1).
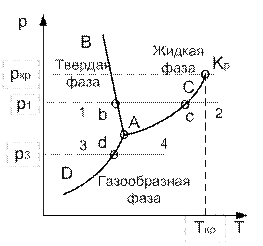
На рис.3.1 представлена качественная pT – диаграмма воды. Тройная точка воды A имеет давление p = 0,0061 бар (610 Па) и температуру t = 0,01о С. При переходе воды из жидкого состояния в газообразное удельный объем ее возрастает ( 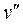 >
> 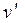 ), а теплота фазового перехода имеет положительное значение ( r > 0); тогда из уравнения (3.1) следует, что с увеличением давления температура фазового перехода будет расти (кривая AC) Неравенство
), а теплота фазового перехода имеет положительное значение ( r > 0); тогда из уравнения (3.1) следует, что с увеличением давления температура фазового перехода будет расти (кривая AC) Неравенство 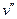 >
> 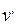 справедливо и при сублимации льда в пар, поэтому с
справедливо и при сублимации льда в пар, поэтому с
уменьшением давления температура
сублимации падает (кривая AD). При переходе из твердого состояния в жидкое для большинства веществ 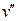 > > 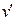 , следовательно, dp/dT>0. Это значит, что давление плавления с увеличени-
ем температуры растет. Однако удельный объем воды при плавлении льда имеет меньшее значение ( , следовательно, dp/dT>0. Это значит, что давление плавления с увеличени-
ем температуры растет. Однако удельный объем воды при плавлении льда имеет меньшее значение ( 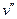 < < 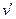 ), и поэтому dp/dT<0, т.е. с увеличением давления температура плавления уменьшается (линия AB ). Если вещество в ), и поэтому dp/dT<0, т.е. с увеличением давления температура плавления уменьшается (линия AB ). Если вещество в
| 
|
твердом состоянии (на рис.3.1 точка 1) Рис. 3.1
нагревать при постоянном давлении p1, то будем иметь следующие процессы:
1-b – нагрев до температуры плавления и переход в жидкую фазу;
b-c – нагрев жидкости до температуры кипения и переход в пар;
c-2 – перегрев пара до температуры T2 .
Если взять состояние 3 с давлением p3 , то при нагреве твердого вещества получим процессы:
3-d – нагрев твердого вещества до температуры сублимации;
d-4 – сублимация и перегрев пара до температуры T4 .
Кривая парообразования AC заканчивается критической точкой Kp .
При температуре, равной критической, взаимные превращения пара и жидкости происходят без поглощения или отвода тепла и без скачкообразного изменения плотности.
3.1.2. Пар и его характеристики
Под паром понимают газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой (твердой) фазой того же вещества.
Для получения пара используется процесс парообразования, хотя пар может быть получен и в процессе сублимации.
Парообразование является следствием испарения и кипения.
Испарение происходит только со свободной поверхности жидкости. Оно протекает при любой температуре и осуществляется за счет покидания жидкости молекулами, обладающими кинетической энергией, достаточной для преодоления поверхностного натяжения и перехода в пространство над жидкостью. Интенсивность испарения зависит от температуры жидкости и от ее природы.
Процесс кипения заключается в том, что при определенной температуре внутри жидкости образуются пузырьки пара. При испарении жидкости внутрь пузырька его размеры растут. Пузырьки, всплывая, выносят пар в окружающую жидкость среду. При интенсивном кипении суммарная поверхность пузырьков может существенно превосходить свободную поверхность жидкости. В этом случае парообразование будет идти в основном за счет кипения.
При парообразовании жидкости в закрытом пространстве одновременно протекает процесс конденсации. При определенных условиях наступит равновесие между жидкостью и паром. Это значит, что при отсутствии внешнего воздействия количественные соотношения между жидкой и газообразной фазами сохраняются неограниченное время.
Газообразную фазу, находящуюся в равновесии с жидкой фазой, называют сухим н а с ы щ е н н ы м п а р о м.
Из условий равновесия давление сухого насыщенного пара (обозначим его pн ) равно давлению фазового перехода: pн = ps.
Характерной особенностью процесса кипения является то, что при заданном давлении жидкость закипает при достижении вполне определенной температуры, и эта температура остается неизменной до полного выкипания жидкости. С другой стороны, экспериментально было установлено, что такая связь справедлива только до определенных значений давления и температуры. Так, с увеличением давления при достижении вполне определенной температуры жидкость во всем объеме превращается в пар, и никаким повышением давления нельзя остановить этот процесс.
Для примера в табл.3.1 даны приближенные значения температур кипения воды при различных давлениях, а в Приложении табл. 8 приведены физические характеристики воды на линии насыщения.
Т а б л и ц а 3.1
| рн, бар | tн, о С | рн, бар | tн, о С |
| 0,006 | |||
| 0,05 | 32,5 | ||
| 0,5 | |||
Значения температуры и давления, при которых вещество может существовать в двух фазах - жидком и газообразном, называют к р и т и ч е с- к и м и и обозначают tкр и pкр . Для некоторых жидкостей критические параметры приведены в табл. 3.2.
Т а б л и ц а 3.2
| Параметр | Жидкость | |||||
| Вода | Керосин | Спирт | Кислород | Водород | Аммиак | |
| p кр , бар | 225,7 | 49,7 | 12,8 | 115,5 | ||
| tкр , оС | -118,8 | -239,9 | 132,4 |
В сухом насыщенном паре при определенных условиях над поверхностью испарения могут образовываться мельчайшие капельки сконденсированной жидкости.
Механическая смесь сухого насыщенного пара и мельчайших капелек жидкости называется в л а ж н ы м паром.
Массовая доля сухого пара во влажном называется с т е п е н ь
с у х о с т и .
Обозначают степень сухости через x и вычисляют как, x = mc /m,
где mc – масса сухого пара;
m – масса влажного пара.
Пар, температура которого выше температуры сухого насыщенного пара при том же давлении, называется п е р е г р е т ы м.
Процессы нагрева и парообразования многих жидкостей в теплотехнической справочной литературе представлены в виде диаграмм в различных системах координат ( pv, Ts, is, pi).
На рис.3.2 представлены качественные диаграммы процессов нагрева
 и парообразования воды в pv (а) и Ts (б) – координатах. На этих диаграммах стрелками показан изобарный процесс парообразования: ab – нагрев жидкости до температуры кипения; bc –испарение жидкости; cd – перегрев пара. Точка e позволят описать состояние влажного пара, а точка d – перегретого пара. Точка К определяет критические температуру и давление. В Ts –координатах заштрихованные площади эквивалентны теплоте, потребного для нагрева жидкости до температуры кипения qж; фазового перехода r,перегрева пара qп.
и парообразования воды в pv (а) и Ts (б) – координатах. На этих диаграммах стрелками показан изобарный процесс парообразования: ab – нагрев жидкости до температуры кипения; bc –испарение жидкости; cd – перегрев пара. Точка e позволят описать состояние влажного пара, а точка d – перегретого пара. Точка К определяет критические температуру и давление. В Ts –координатах заштрихованные площади эквивалентны теплоте, потребного для нагрева жидкости до температуры кипения qж; фазового перехода r,перегрева пара qп.
Рис. 3.2
Дата добавления: 2015-02-16; просмотров: 1165;
