ПАТОГЕНЕЗ
В формировании очага воспаления с момента его возникновения до исхода вне зависимости от причин, локализации, видовых и индивидуальных особенностей организма животного выделяют три основных компонента. Они взаимосвязаны и по мере выраженности определяют характер развивающегося патологического процесса. Развитие воспаления определяется контактом тканей с флогогенным агентом и последующей альтерацией, расстройствами микроциркуляции, возрастанием проницаемости гистогематических барьеров, скоплением в тканях воспалительной жидкости — экссудата, эмиграцией лейкоцитов, ростом молодых клеточных элементов — пролиферацией. Все эти явления взаимозависимы, их трудно разграничить, тем не менее они имеют свои характерные особенности, знание которых помогает лучше понять механизм реализации изучаемой патологии.
Альтерация (от лат. alterare — повреждать). Под альтерацией понимают функциональные и структурные изменения в тканях, вызванные флогогенным агентом. Повреждение клеточных элементов крови, тканей, нервных рецепторных образований, не являясь, по существу, компонентом воспаления, служит пусковым, триггерным (от англ, trigger — пусковой крючок), механизмом ответной реакции организма в виде воспалительной реакции.
Рассматривают первичную и вторичную альтерацию.
Первичная альтерация возникает в рамках гистиона — территории, включающей клетки, ткани, нервные элементы в зоне микроциркуляторного русла, состоящего из артериол, прекапилляров, капилляров, посткапилляров и венул. Она вызывается контактом гистиона с повреждающим фактором — механическим, термическим, химическим, микробиальным и другими, а чаще их сочетанием.
В очаге повреждения сразу можно наблюдать мозаичную картину морфологических изменений. Одни клетки подвергнуты полному разрушению — некрозу, другие могут находиться в состоянии некробиоза, третьи — с той или иной формой дистрофии. Нарушаются обменные процессы и функциональная активность клеток, органов, тканей. Меняется возбудимость рецепторов. Их прямое и опосредованное раздражение является источником патологической импульсации, вовлекающей в ответную реакцию регуляторные системы — нервную, эндокринную, иммунную, сердечно-сосудистую.
Вторичная альтерация может быть обусловлена продолжающимся действием флогогена (бактериальные и другие токсигены) и факторами первичной альтерации, активными даже после прекращения действия причины.
Изначальная травматизация тканей приводит к разрушению мембранных структур клетки и субклеточных образований. Особую значимость в развитии вторичной альтерации приобретают ферменты лизосом. Они определяют аутолиз («самопереваривание») поврежденных клеток, а освободившиеся внеклеточные лизосомальные ферменты продолжают процесс альтерации, деструкции клеток уже вне зависимости от присутствия воспалительного агента. Разрушенные и стимулированные клетки становятся источником поступления в гуморальные среды большого количества биологически активных веществ — медиаторов и модуляторов воспаления. Медиаторы — обычные вещества, регулирующие жизнедеятельность организма, в избытке появляющиеся при альтерации тканей. Они становятся основой причинно-следственных отношений, стимулируя, например, при воспалении повышение проницаемости гистогематических барьеров, за которым следует выход, форменных элементов и белка за пределы сосудов. Эмигрировавшие микро- и макрофаги приступают к фагоцитозу и элиминации возбудителя. В динамике воспаления концентрация одних медиаторов уменьшается, других — возрастает. Таким образом, медиаторы обнаруживают признаки модуляторов, усиливая или снижая проявления воспалительного процесса.
Медиаторы воспаления в зависимости от происхождения делят на две группы. Вещества, синтезируемые клетками, названы клеточными медиаторами, а образующиеся в межклеточной среде, лимфе, плазме крови — гуморальными.
С усовершенствованием методик и углублением представлений о биохимических трансформациях, происходящих в альтерированных тканях, становится известным все большее число соединений, обладающих свойствами медиаторов (модуляторов) воспаления. В качестве примера отметим наиболее значимые из них.
Клеточные медиаторы воспаления:
™ адреналин и норадреналин. Высвобождаются возбужденными адренергическими структурами, определяют первоначальный спазм сосудов, способствуют снижению их проницаемости;
™ ацетилхолин. Выделяется возбужденными холинергическими структурами. Расширяет сосуды, стимулирует аксон-рефлексы в механизме развития артериальной гиперемии;
™ гистамин. Освобождается тучными клетками и базофилами. Расширяет артериолы и суживает венулы, создавая повышенное давление в капиллярах, способствует проницаемости гистогематического барьера;
™ серотонин. Выбрасывается лаброцитами, базофильными лейкоцитами, тромбоцитами. Усиливает дилатационный эффект гистамина. Перечисленные вазоактивные вещества определяют первоначальные микроциркуляторные расстройства;
™ лизосомальные ферменты. Главным источником их являются моноциты/макрофаги и гранулоциты. Стимуляция, повреждение и гибель этих и других клеток сопровождаются освобождением из лизосом гидролаз, расщепляющих белки (протеиназы), липиды (липазы), углеводы (амилазы). Ферменты, высвобождаемые из лизосом, уже сами по себе продолжают деструктивные процессы в тканях, определяют вторичную альтерацию путем стимуляции комплемента системы, освобождения цитокинов, в их числе группы интерлейкинов, активации калликреинкининовой системы, модуляции системы свертывания крови. Лизосомальные ферменты в состоянии поддерживать воспалительный процесс длительный период времени;
™ активированные кислородные метаболиты (Н2О2; О- 2; ОН-; NO-; HO2; RO2 и др.). Освобождаются фагоцитами при стимуляции («дыхательный взрыв») по ходу ферментативных процессов в митохондриях, других субклеточных образованиях;
™ кейлоны (гликопротеиды с молекулярной массой 40 000 Д). Их основным источником являются сегментоядерные нейтрофилы. Кейлоны ингибируют клеточное деление за счет инактивации ферментов, ответственных за редупликацию ДНК. Снижение числа зрелых нейтрофилов в очаге воспаления по мере его затухания уменьшает образование кейлонов, поэтому клетки начинают усиленно делиться, преобладают пролиферативные процессы.
™ Медиаторы клеточного происхождения включаются в ответную реакцию на первичную и вторичную альтерацию, на генетически чуждые организму белки эндогенного и экзогенного происхождения. Они вовлекают иммунные механизмы со сложными взаимоотношениями между иммунокомпетентными клетками. Инициатором иммунного ответа является стимулированный макрофаг, освобождающий интерлейкин-1, с последующим вовлечением Т-и В-систем иммунитета.
Жидкие среды организма (кровь, лимфа, тканевая жидкость) также активно участвуют в реализации воспалительного процесса. Наиболее значимыми медиаторами гуморального происхождения являются:
k эйкозаноиды — продукты метаболизма арахидоновой кислоты, среди которых в очаге воспаления преобладают простагландины, лейкотриены, тромбоксан А2, другие вещества этой группы медиаторов. Образуются стимулированными микро- и макрофагами. Эйкозаноиды — важнейшие соединения, обеспечивающие хемотаксис, регуляцию лейкоцитарной инфильтрации, фагоцитоза. Простагландину Е2 отводят роль пирогенного активатора, запускающего лихорадочную реакцию;
k кинины — физиологически активные пептиды. Образуются в гуморальных средах из кининогена под действием калликреинов. Одним из них является брадикинин. Это вазоактивное вещество стимулирует контрактацию эндотелиальных клеток, сокращение гладкомышечного аппарата вен, чем обеспечивает повышение проницаемости сосудов. Кинины вызывают болевую реакцию при воспалении. Усиливают пролиферацию фибробластов и синтез коллагена, определяя хронизацию воспаления или его завершение;
k производные комплемента, особенно С3, С5, С9 и их комплексы, способствуют освобождению клетками гистамина, интерлейкина-1, простагландинов, лейкотриенов. Производные комплемента опсонируют микроорганизмы, обладают хемотаксическими и цитолитическими свойствами.
k Вторичная альтерация представляет собой результат воздействия на соединительную ткань и микрососуды лизосомальных ферментов и активированных кислородных метаболитов. Она определяется преимущественно активностью системы мононуклеарных фагоцитов. В условиях эксперимента показано значительное снижение выраженности альтерации у животных с предварительно вызванной лейкопенией. Ингибирующий эффект оказывают и антиоксиданты.
Экссудация, эмиграция, диапедез. Альтерация сразу же приводит к расстройству лимфо- и кровообращения в очаге воспаления, на территории гистеона. Первоначальным этапом запуска ответных реакций организма на повреждение является медиаторная реакция из двух взаимодополняющих звеньев: нейро- и липидомедиаторного.
Выявлено, что уже в первые секунды после альтерирующего влияния флогогена сенсорные нервные волокна, участвующие в ноцицепции (от лат. посео — повреждаю, receptivus — восприимчивый), выделяют особые сенсорные нейропептиды: субстанцию Р, пептид гена, родственного кальцитонину, и пептид протеинового гена. Выделенные вещества обладают мощным сосудорасширяющим эффектом. Вазодилатация усиливается благодаря синергическому влиянию второго медиаторного звена. Вслед за нейрон медиаторами в следующие минуты после повреждения основную роль в развитии воспаления берут на себя липидные медиаторы, образованные из липидов мембран поврежденных клеток. Путем биохимических превращений из содержащейся там арахидоновой кислоты образуются простагландины, простациклины, тромбоксаны, лейкотриены, перекиси и гидроперекиси жирных кислот.
Простагландины выступают как синергисты таких медиаторов воспаления, как гистамин, брадикинин. Они обладают сосудорасширяющими свойствами, определяя развитие артериальной гиперемии.
Усилению вазодилатации способствует повышение концентрации NO-радикалов в очаге воспаления.
Со временем артериальная гиперемия переходит в венозную. Это обусловлено механическим препятствием оттоку крови вследствие образования тромбов в венах. Повреждения сосудистой стенки активируют фактор Хагемана, который инициирует систему свертывания крови. Выход плазмы за пределы сосудов ведет к их сдавливанию; снижается тонус нервно-мышечного аппарата, Увеличивается площадь сечения вен из-за лизирования дермосом.
Ток крови замедляется, затем переходит в маятникообразные движения с последующим стазом. Стаз ведет к агрегации эритроцитов, стиранию границ между ними. Наблюдаемый феномен «сладжа» необратим.
Экссудация (от лат. exsudo — выпотеваю, выделяю) — выход плазмы крови и форменных элементов за пределы кровеносных сосудов. Жидкость, выходящая за пределы сосудов, носит название экссудата, который отличается сравнительно высоким содержанием белка (до 5 %), обилием ферментов, форменных элементов крови, интерлейкинов, продуктов распада тканей. При септическом воспалении экссудат содержит микроорганизмы.
В числе факторов, определяющих экссудацию, первостепенное значение имеет проницаемость сосудов микроциркуляторного русла. Повышают сосудистую проницаемость липидные медиаторы, гистамин, брадикинин, фосфолипидный фактор активации тромбоцитов, эндогенные оксиданты — гипохлорит и хлорамин. Разрыв клеточных контактов путем ретракции цитоскелета эндотелиальных клеток, вызываемый эндогенными оксидантами, делает возможным выход плазмы за пределы сосудов, эмиграцию лейкоцитов. Этому способствует гепарин, выделяемый околососудистыми тканевыми базофилами.
Экссудация также определяется нарастанием гидростатического давления в венозной части капилляра, повышением осмотического и онкотического давления в межклеточном матриксе, микровезикулярным транспортом. Микропиноцитоз энергозависим, представляется самостоятельным компонентом экссудативного процесса.
Интенсивность воспалительной реакции, степень проницаемости гистогематического барьера определяют количественный и качественный состав белков экссудата. При малых повреждениях наблюдается преимущественная экссудация жидкости и низкомолекулярных соединений, усиление повреждения приводит к выходу высокомолекулярных соединений и клеток крови. Сквозь стенку кровеносных сосудов начинают мигрировать лейкоциты, которые передвигаются в направлении фокуса воспалительного очага.
Выход лейкоцитов за пределы стенок сосудов носит название эмиграции. Эмиграция начинается с краевого состояния лейкоцитов, когда они замедляют движение вдоль стенки сосудов, а затем останавливаются. Установлено, что при гнойно-воспалительных заболеваниях нейтрофилы еще до поступления в очаг воспаления приходят в состояние гиперактивности. Снижается гранулированность их цитоплазмы, на поверхности появляются филоподиоподобные выросты. Интима сосудов при воспалении выстилается тончайшей пленкой, в состав которой входят фибрин, гликопротеиды, сиаловые кислоты, другие соединения. Это способствует повышенному контакту лейкоцитов с клетками эндотелия сосудов гистеона. Краевому стоянию содействуют электрохимические связи, появление «кальциевых мостиков».
Лейкоцит может мигрировать сквозь стенку сосуда либо путем микропиноцитоза эндотелиоцитом, либо преодолевая преграду между двумя округлившимися клетками эндотелия путем образования псевдоподий. Базальную мембрану полиморфноядерные лейкоциты преодолевают, выделяя протеазы гиалуронидазу, эластазу, коллагеназу — ферменты, увеличивающие ее проницаемость. Эмигрировавшие из сосудов лейкоциты начинают амебовидное движение по межклеточному матриксу к предмету взаимодействия — микроорганизмам или поврежденным клеткам (рис. 9).

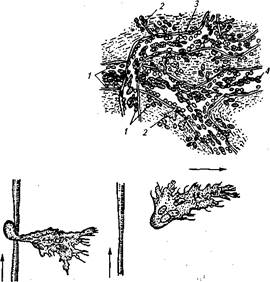
Рис. 9. Эмиграция лейкоцитов при воспалении брыжейки лягушки:
1- краевое стояние лейкоцитов; 2- эмиграция лейкоцитов; 3- эмигрировавшие лейкоциты; 4- эритроциты
По наблюдениям, краевое стояние лейкоцитов может продолжаться до 30 мин, переливание сквозь стенку сосуда занимает 20— 40 мин, передвижение по тканевым щелям к конечной цели может длиться часы и сутки.
Лейкоциты, противостоящие возбудителям заболеваний, освобождающие организм от собственных, генетически чуждых клеток, их обломков, инородных тел, были названы И. И. Мечниковым (1892г.) фагоцитами (от греч. phagos — пожиратель, kytos — клетка), а способность бороться против чужеродного начала — фагоцитозом. Фагоциты подразделяют на микрофаги и макрофаги. К микрофагам относят гранулоциты (базофилы, эозино-филы, нейтрофилы) и лимфоциты, к макрофагам — моноциты крови, гистиоциты мезенхимальной (соединительной) ткани, альвеолярные, плевральные и перитонеальные макрофаги, свободные и фиксированные макрофаги красного костного мозга, селезенки, лимфоузлов, клетки Купфера в печени, макрофаги синовиальных оболочек суставов, клетки микроглии нервных образований, остеокласты.
Процесс фагоцитоза сложный, многоэтапный. Начинается он сближением фагоцита с возбудителем, затем наблюдают «прилипание» микроорганизма к поверхности фагоцитирующей клетки, поглощение с образованием фагосомы, внутриклеточное объединение фагосомы с лизосомой (лизофагосома), переваривание объекта фагоцитоза лизосомальными ферментами и его полную элиминацию (от лат. elimino — выношу за порог, удаляю).
Однако не всегда клетки взаимодействуют по подобному сценарию. Вследствие ферментативной недостаточности лизосомальных протеаз фагоцитоз может быть неполным, т. е. микроорганизмы могут сохраняться в фагоците в латентном состоянии. При неблагоприятных для макроорганизма условиях бактерии становятся способными к размножению и, разрушая фагоцитарную клетку, вызывать реинфекцию.
При гнойно-септических процессах, острой травме в очаге воспаления накапливаются преимущественно нейтрофилы. Их появление рассматривается как важный фактор борьбы с патогенными возбудителями. Однако в инфицированной ране, где стимулируется метаболическая активность нейтрофилов, их важнейшей функцией, как выяснилось, является не только фагоцитоз микробов, но и разрушение погибших тканевых элементов за счет активной секреции ферментов во внеклеточную среду. Секреция нейтрофилами протеиназ, миелопироксидазы, катионных белков, эластазы, коллагеназы приводит к деградации межклеточного матрикса очага воспаления. Нейтрофилы инициируют каскад реакций воспалительного процесса, выбрасывая и медиаторы, вызывающие хемотаксис макрофагов, активацию системы комплемента, калликреин-кининовой системы, системы свертывания крови.
В последующем гистогематический барьер преодолевают моноциты. В очаге воспаления они активизируются и приобретают свойства макрофагов, тканевых фагоцитирующих клеток. Их мембрана становится «липкой», в цитоплазме накапливаются гранулы, наполненные протеазами. Фагоциты усиленно поглощают кислород и генерируют («кислородный взрыв») активные формы кислорода — пероксид водорода (Н2О2), оксид азота (NO), гипохлорит (Сl-), синглетный кислород О-2 и др. Эти высокореактивные соединения обладают выраженной бактерицидностью и широким спектром биологической активности: NO--радикалы регулируют тонус сосудов, ингибируют адгезию гранулоцитов к эндотелию сосудов и агрегацию тромбоцитов; Н2О2 и гипогалоиды важны для микробоцидного действия нейтрофилов; О2 индуцирует, a NO ингибирует пролиферацию лимфоцитов. В условиях повреждения нарушается баланс кислородные метаболиты — антиоксиданты. Возрастает продукция первых, уменьшается активность ферментативных и неферментативных антиоксидантов. Эта диспропорция приводит к активации деструктивных процессов — «окислительному стрессу». При их превалировании стали говорить о «свободнорадикальной» патологии.
Кроме того, активированные макрофаги начинают выделять в окружающую среду мощные медиаторы воспаления, среди которых особо активны так называемый фактор некроза опухолей, α-интерферон (Int α) и интерлейкин-8 (ИЛ-8).
Фактор некроза опухолей инициирует синтез на мембране эн-дотелиоцитов сосудов специфических «белков прилипания», способствующих адгезии нейтрофилов и моноцитов. Интерлейкин-8 наряду с другими факторами стимулирует нейтрофилы и моноциты к диапедезу и миграции в очаг воспаления. Фагоциты имеют рецепторы к ИЛ-8, воспринимающие изменения его концентрации, и направляют свое движение по оси максимального отличия. Интерлейкин-8 — «многоцелевой» медиатор воспаления с главной функцией — активацией нейтрофилов и аутоактивацией макрофагов. В лизосомах фагоцитов резко усиливается синтез протеаз, стимулируется «кислородный взрыв» с освобождением высокотоксичных для микроорганизмов активированных кислородных метаболитов, увеличивается рецепторное поле поверхности макрофагов, что способствует «прилипанию» бактерии.
Фагоцитоз — не единственный механизм защиты, реализуемой в очаге воспаления. При разных формах воспаления увеличивается продукция кининов. Им придают исключительное значение при воспалениях аллергического происхождения.
Особо важная защитная роль принадлежит системе комплемента (С). Система комплемента распознает чужеродную клетку и запускает цепную реакцию активации составляющих ее белков (С1 — С9), обладающих энзиматическими свойствами. Фиксируясь на оболочке бактерии, они погружаются в мембрану, полимеризуются в кольцо, образуя поры, «продырявливающие» оболочку бактерии, что ведет ее к гибели. Система комплемента многофункциональна: ее пептиды активируют тучные клетки, выделяющие гистамин, генерируют медиаторы воспаления, усиливают фагоцитоз.
При воспалениях септического происхождения в защиту вовлекается иммунная система.
Микроорганизмы поглощаются антигенпрезентующими клетками — макрофагами, клетками лимфоузлов, селезенки, эндотелия. Антиген подвергается энзиматическим превращениям, и его фрагменты появляются на внешней мембране фагоцита. Здесь он взаимодействует с белками главного комплекса гистосовместимости и презентуется Т- и В-клеткам. Активированный макрофаг становится источником цитокинов, регулирующих функции иммунокомпетентных клеток и органов. Инициируется образование провоспалительных интерлейкинов (ИЛ) —ИЛ-1, ИЛ-6, ИЛ-8, фактора некроза опухолей. Спустя 2 ч их обнаруживают уже за пределами антигенпрезентующих клеток. Концентрация интерлейкинов достигает максимального уровня через 24—48 ч.
Под влиянием провоспалительных интерлейкинов активируются разные типы лейкоцитов, клетки эндотелия, фибробласты, кератиноциты, усиливаются основные функции нейтрофилов, цитотоксичность естественных киллеров, выброс гистамина тучными клетками, синтез простагландинов Е2 кератиноцитами.
Интерлейкины активны не только в очаге поражения. Ими (ИЛ-1, ИЛ-6, ФНОα) стимулируется пролиферация Т- и В-лимфоцитов — хелперов. В свою очередь, Т-хелперы начинают выбрасывать последующие серии интерлейкинов (ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5), регулирующих дальнейший ход иммунных преобразований. В конечном итоге В-лимфоциты трансформируются в клоны плазмоцитарных клеток, синтезирующих иммуноглобулины (IgG, IgA, IgM, IgE) — антитела, направленные на нейтрализацию антигенного раздражителя (микробы, генетически чужеродные субстанции).
Последующий ход развития воспаления определяется взаимоотношением гематогенных (лимфоциты, тромбоциты, эритроциты) и гистиогенных клеток (эпителий, лаброциты, адвентициальные и эндотелиальные клетки сосудов, фибробласты, ретикулярные клетки), интерлейкинов и факторов роста.
Пролиферация (от лат. proles — потомство, fero — несу) — разрастание тканей организма животного за счет размножения клеток. Повреждение тканей сопровождается образованием не только провоспалительных медиаторов, но и факторов, стимулирующих восстановление поврежденных как субклеточных структур, так и самих клеток, тканей. Активированные нейтрофилы и макрофаги выделяют специфический медиатор — трансформирующий фактор роста β1 (ТФРβ1].
Взаимодействие интерлейкина-1, фактора некроза опухоли а, трансформирующего фактора роста β1 активирует рост и размножение клеточных элементов. Процесс замещения погибших клеток в незначительной степени выявляют уже в ходе развития альтеративных и экссудативно-пролиферативных процессов. Свое же наибольшее выражение он приобретает в завершающей фазе воспаления. По мере освобождения очага поражения от возбудителей и погибших клеток меняется клеточный состав экссудата. Уменьшается содержание нейтрофилов, других сегментоядерных гранулоцитов. К настоящему времени выявлен один из важных путей клиренса гематогенных клеток из очага воспаления путем запрограммированной гибели, получившей название апоптоза. Установлено, что стареющие нейтрофилы, лимфоциты, эозинофилы расчленяются на отдельные апоптозные тела путем фрагментации хроматина, без разрушения клеточных мембран, без выброса лизосомальных ферментов в экстрацеллюлярные пространства. Уже в ходе апоптозной трансформации клетки теряют возможность секретировать протеолитические ферменты, способствуя затуханию воспаления. Макрофаги легко поглощают фрагменты апоптозных лейкоцитов. Апоптозные тела не инициируют образования провоспалительных цитокинов.
Погибающие гранулоциты замещаются моноцитарными клетками — макрофагами и лимфоцитами. Макрофаги завершают фагоцитоз погибших клеток и продуктов их распада. Часть лимфоцитов под влиянием интерлейкинов преобразуется в плазматические клетки, продуцирующие антитела, инактивирующие антигены.
В восстановлении поврежденных тканевых структур принимают участие гематогенные и гистиогенные клетки. В числе последних эндотелиоциты, адвентициальные клетки, дифференцирующиеся в фибробласты, камбиальные клетки паренхимы органов, эпителий кожи, желез, слизистых оболочек.
Пролиферация начинается с периферии очага повреждения образованием так называемой грануляционной ткани. Свое название она получила из-за наличия гранулем (от лат. granulum — зернышко). Центр гранулемы представлен капилляром, сформированным из эндотелиальных клеток и клеток адвентиции, окруженных мезенхимальными элементами. Узелки сливаются и образуют демаркационный вал — барьер, отделяющий очаг воспаления от здоровой ткани. Основное значение в последующем принадлежит образующимся в результате дифференцировки клеток соединительной ткани фибробластам.
Рост и размножение камбиальных эпителиальных клеток и элементов ретикулоэндотелиальной системы имеет сложную регуляцию. Один из таких регуляторов — тромбоцитарный фактор роста, вырабатываемый, кроме тромбоцитов, эпителиальными и эндотелиальными клетками. ТФР β1, усиливает пролиферацию фибробластов, которые, в свою очередь, начинают секретировать простагландины, ингибирующие образование Т-клеток и продукцию ими провоспалительных интерлейкинов. Другой регулирующий механизм — продуцирование клетками тканеспецифических гликопротеидов — кейлонов. Эти вещества, накапливаясь в зрелых клетках, тормозят их рост. Чем меньше зрелых клеток, а это характерно для пораженного гистеона, тем больше кейлонов и выше их ростостимулирующий эффект. Стимулируют пролиферацию и минералокортикоидные гормоны надпочечников.
Со временем грануляционная ткань претерпевает изменения. Количество сосудов и клеток в ней уменьшается. Фибробласты пролиферируют, дифференцируются в зрелые формы — фиброциты, которые синтезируют коллагеновые волокна, формирующие рубцовую ткань. Пролиферативные процессы представляют собой подготовительный этап репаративного периода. В случаях сравнительно небольших повреждений, особенно эпителия кожи, слизистых оболочек, воспаление завершается регенерацией — восстановлением структуры и функции ткани. При обширных повреждениях тканевый дефект замещается рубцовой тканью.
Участие нервной и эндокринной систем в генезе воспаления. Возникающая взаимосвязь между очагом повреждения, вызванным флогогенным агентом, и организмом определяется прежде всего функциональным состоянием нервной и эндокринной систем. Центр воспаления и прилегающие к нему ткани становятся мощным очагом патологической импульсации. Характер такой импульсации неоднороден. Он зависит от степени альтерации, природы флогогена, длительности его действия, других факторов.
Развитие воспаления, как показывают экспериментальные данные и клинические наблюдения, сопряжено с участием всех звеньев рефлекторной дуги. Рефлекторным влиянием объясняют первоначальный спазм сосудов при воспалении, а последующую вазодилатацию в немалой степени связывают с аксон-рефлексами. Деафферентация очага воспаления сопровождается усилением отека, ослаблением эпителизации, деструктивными явлениями. Вовлеченность центральных отделов нервной системы в воспалительный процесс доказывается у морских свинок возможностью условнорефлекторного образования экссудата, а у собак появлением хронических дерматитов при экспериментальных неврозах. Выявлено резкое торможение воспалительных процессов у животных в период зимней спячки. Эфферентное звено рефлекторной дуги представлено сосудодвигательными и трофическими нервами. Под нервной трофикой понимают свойство нервной системы регулировать обменные процессы, определяющие не только функцию, но и структуру клеток. Расстройства нервной трофики приводят к появлению кератита, изъязвлению и некрозу склеры после перерезки тройничного нерва у подопытного животного, развитию пневмонии у кролика после размозжения верхнего шейного симпатического узла. Воспаление может возникать спонтанно на симметричных участках тела. Все это позволяет некоторым ученым считать воспаление нервнотрофическим процессом.
Функциональная активность нервной системы в генезе воспалительного процесса тесно связана с деятельностью желез внутренней секреции. Центральное место во взаимоотношениях нервной и эндокринной систем занимает гипоталамо-гипофизарно-надпочечниковая система. Статины и либерины гипоталамуса ослабляют или стимулируют выделение тропных гормонов аденогипофиза, принимающих участие в регуляции воспаления. Среди, них важнейшее значение имеет адренокортикотропный гормон. Он с кровью переносится в надпочечники, стимулирует секреторную деятельность коркового и мозгового слоев железы. Повышается содержание кортикостероидов, которые оказывают выраженное влияние на мезенхимальную ткань и ее производные.
Глюкокортикоиды (кортизон, гидрокортизон, кортикостерон, прочие гормоны этой группы) подавляют воспалительную реакцию, понижая проницаемость сосудистой стенки, уменьшая экссудацию, подавляя выработку антител, ингибируя аутоаллергические реакции. Они предотвращают распространение воспаления за пределы границ первичной альтерации. Стероиды подавляют такие ранние признаки воспаления, как краевое стояние лейкоцитов, их миграцию за пределы стенок капилляров, тормозят антисвертывающую систему крови. Повышается готовность крови к тромбообразованию, ослабляется фибринолиз. Уменьшается интенсивность продуктивных процессов в соединительной ткани путем торможения синтеза коллагена. Повышенный выброс глюко-кортикоидов в кровь приводит к инволюции тимуса, к лимфоли-тическому эффекту. Глюкокортикоиды принимают участие также в процессах образования и утилизации энергии, освобождаемой при окислении углеводов, жиров, белков.
Минералокортикоиды(альдостерон, дезоксикортикостерон и др.) в отличие от глюкокортикоидов — провоспалительные гормоны. Их секреция регулируется кортикотропином, концентрацией ионов Na+ и К+ в крови, объемом внеклеточной жидкости. Под влиянием альдостерона повышается проницаемость сосудистой стенки, что способствует усиленной экссудации и эмиграции лейкоцитов, проявлению внешних признаков воспаления.
В регуляцию воспаления вовлекается щитовидная железа. Альтерация способствует повышенной секреции гипоталамусом тире-олобелина. Выделяемый в ответ тиреотропный гормон гипофиза стимулирует функцию щитовидной железы, синтез тироксина и трийодтиронина. Эти гормоны обладают выраженными профлогистическими свойствами. Они тормозят антифибринолитическую активность, усиливают рост грануляционной ткани. Гипофункция щитовидной железы сопровождается ослабленным проявлением воспалительного процесса.
Гормоны половых желез (тестостерон и эстрогены) повышают резистентность организма животных, ограничивают развитие воспаления, подавляют пролиферативные процессы.
Состояние инсулярного аппарата поджелудочной железы заметным образом сказывается на характере воспалительной реакции. У больных диабетом повышена склонность к септическим воспалениям первичного (туберкулез) и вторичного (постоперационные осложнения) происхождения. Снижена фагоцитарная функция лейкоцитов, ослаблена общая резистентность организма.
К провоспалительным гормонам относят и соматотропный гормон передней доли гипофиза.
Модулирующее действие гормонов при воспалении проявляется как в непосредственном влиянии на сосудистую стенку с изменениями микроциркуляции и проницаемости, так и опосредованно, путем взаимодействия с рецепторными образованиями мембран секреторных клеток, продуцирующих многочисленные медиаторы воспаления.
Дата добавления: 2015-02-10; просмотров: 1415;
