Картирование при трансдукции
При трансдукционном скрещивании фаг, способный осуществлять трансдукцию, размножают на чувствительных к нему клетках бактерии-донора. Полученным лизатом инфицируют клетки бактерий-реципиентов. Для селекции рекомбинантов (их называют трансдуктантами), получивших фрагмент хромосомы донора от трансдуцирующего фага, необходимо, как обычно, различие донора и реципиента по одному, двум или нескольким признакам.
Например: размножаем фаг на клетках дикого типа, не нуждающихся в факторах роста, и полученным фаголизатом инфицируем штамм ауксотрофный по аминокислоте треонину (Thr-). Если клетка реципиента инфицируется трансдуцирующим фагом, несущим фрагмент ДНК донора с геном thr+, то этот ген может включиться путем кроссинговера в хромосому этой клетки, заменив мутантную аллель thr. В результате образуется среди реципиентных клеток прототрофная клетка-трансдуктант, способная расти без треонина. Из массы реципиентных клеток Thr- ее можно выделить на селективной среде без треонина, на которой все остальные не трансдуцированные клетки размножаться не будут. В данном примере Thr является селективным маркером. Частота трансдуктантов вычисляется как отношение числа колоний с фенотипом Thr+ к общему количеству жизнеспособных клеток реципиента.
Для определения сцепления используют двухфакторные скрещивания. Например: фаг размножают на штамме с фенотипом Thr+Leu+ и инфицируют фаголизатом клетки реципиента, нуждающегося в этих аминокислотах (Thr- Leu-). После обработки фагом клетки высевают на среду без треонина, но с добавлением лейцина. Или, наоборот, без лейцина, но с треонином. В первом случае в качестве селективного маркера используют потребность в треонине, а во втором – потребность в лейцине. На среде не будут расти нетрансдуцированные реципиентные клетки, а вырастут клетки, получившие фрагмент хромосомы донора с селектируемым геном. Если на этом же фрагменте локализуется второй исследуемый ген, то среди выросших трансдуктантов Thr+ (Leu+) могут встретиться двойные трансдуктанты Thr+Leu+. Их можно выявить? перепечатав полученные колонии трансдуктантов на среду без треонина и лейцина. Потребность в лейцине (или в треонине) является неселективным маркером и служит для выявления частоты совместного переноса. Явление совместного переноса получило название котрансдукции. Частота котрансдукции определяется отношением числа двойных трансдуктантов (Thr+Leu+) к числу всех (Thr+).
Например: частота совместной трансдукции генов purВ и gal U составляет 2%. Это означает, что в том случае, когда мы трансдуцируем штамм Pur-Gal-, используя фаголизат, приготовленный из штамма дикого типа, и ведем отбор по признаку Pur+, 2% Pur+ трансдуктантов будет также Gal+.
В экспериментах по выявлению котрансдукции следует исключить возможность попадания двух фрагментов хромосомы донора в реципиентную клетку вследствие ее инфицирования двумя трансдуцирующими фагами (явление множественной инфекции). Для этого необходимо учитывать число фаговых частиц в фаголизате. Отношение числа фаговых частиц к числу обрабатываемых реципиентных клеток должно быть меньше 1.
Определение частоты котрансдукции является одним из способов суждения о степени сцепления маркеров – вероятность совместного включения тем выше, чем теснее сцеплены локусы.
Например: фаг размножаем на клетках Thr+Leu+Azir и затем полученным препаратом фага инфицируем реципиента Thr-Leu-Azis, при отборе по треонину лишь 3% от рекомбинантов Thr+ обладают также фенотипом Leu+ и ни один из них – фенотипом Azir. Однако если отбирать рекомбинанты по лейцину, то 50% из них составляют Azir. Следовательно, leu+ более тесно сцеплен с azir, чем с thr+.
С помощью дифакторных скрещиваний можно установить сцепление между мутациями, вызывающими ауксотрофность по одному и тому же фактору роста. Для этого фаг, выращенный на одном ауксотрофном мутанте, применяют для трансдукции второго ауксотрофного мутанта. Учитывают частоту прототрофных трансдуктантов. Частоту трансдукции данного опыта сравнивают с частотой трансдукции второго опыта, где фаг выращивают на штамме дикого типа и используют для трансдукции того же самого ауксотрофного реципиента. Если частота трансдукции в первом опыте значительно ниже таковой во втором, то исследуемые мутации сцеплены.
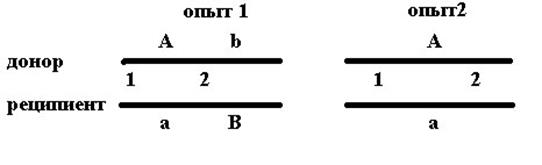
|
Как видно из схемы, при сцеплении генов для образования прототрофных рекомбинантов в первом опыте кроссинговер в участке 1 должен сопровождаться кроссинговром в коротком интервале 2 между генами а и b; во втором опыте второй кроссинговер может происходить в любом месте длинного интервала между геном а и правым плечом фрагмента.
В трехфакторных скрещиваниях частоты котрансдукции можно использовать для определения степени сцепления и последовательности расположения маркеров. Для этого в опытах по трансдукции необходимо определять четыре параметра (в мл): число внесенных фаговых частиц; число реципиентных клеток; число трансдуктантов и число котрансдуктантов.
Пример: донор Pur+ Nad+ Pdx-
реципиент Pur-Nad-Pdx+
Селектируемый маркер: Pur+.
| Результат анализа неселективных маркеров: | Колонии |
| Nad+ Pdx+ | |
| Nad+ Pdx- | |
| Nad- Pdx+ | |
| Nad- Pdx- | |
| Всего: |
Частота котрансдукции: Pur+ Nad+ = 13/50 (0,26)
Pur+ Pdx- = 23/50 (0,46)
Аллель pdx наследуется совместно с pur+ в 46% случаев, в то время как аллель nad+ – в 26%. Поскольку множественность инфекции (отношение фаговых частиц к числу бактерий) была равна 0,17, то вероятность попадания нескольких фагов в клетку составляет только 1%. Следовательно, можно сделать заключение о расположении обоих генов на одном и том же фрагменте ДНК. Локус pdx теснее примыкает к локусу pur, чем к локусу nad.
Для приведенных в примере трех генов можно предположить две последовательности: А) pur-pdx-nad или В) pdx-pur-nad. Выбор между разными последовательностями трех маркеров делают на основании числа кроссоверных обменов, необходимых для образования выделенных рекомбинантов, т.е. используют критерий минимума множественных кроссинговеров.
В двух случаях предполагаемых последовательностей генов генотип мерозиготы будет выглядеть следующим образом:
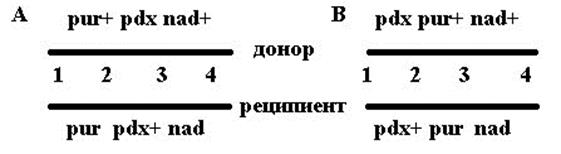
|
При этих двух порядках для возникновения жизнеспособных рекомбинантов разных типов потребуется разное число кроссинговеров.
| Генотип трансдуктанта | Перекрест в участке при последовательности | |
| А | В | |
| pur+ nad+ pdx+ | 1,2,3,4 | 2,4 |
| pur+ nad+ pdx- | 1,4 | 1,4 |
| pur+ nad- pdx+ | 1,2 | 2,3 |
| pur+ nad- pdx- | 1,3 | 1,3 |
Видно, что при последовательности генов А для образования рекомбинантов Pur+Nad+Pdx+ необходимо прохождение четырех кроссинговеров в отличие от всех других случаев. Так как вероятность четверного кроссинговера ниже вероятности прохождения двойного, то если в скрещивании класс трансдуктантов Pur+Nad+Pdx+ встречается с меньшей частотой относительно остальных, то порядок генов как в случае А, если же этот класс по частоте не будет отличаться от других, то порядок генов как в случае В. Тип трансдуктантов, для образования которого необходимо четыре кроссинговера, называют критическим. Из результатов эксперимента, описанного в примере, видно, что трансдуктантов критического типа получено всего 3, меньше чем всех остальных. Это могло быть только при последовательности А. Следовательно, этот порядок предпочтителен.
При трансдукции легко проводить трехфакторные реципрокные скрещивания. В них можно определить последовательность генов в хромосоме, когда эксперименты по котрансдукции не позволяют этого сделать. Например, если гены очень тесно сцеплены, то они будут все котрансдуцироваться с высокой частотой и различия в котрансдукции будут недостоверны.
Анализ нелизогенных трансдуктантов, полученных при специфической трансдукции, проводят так же, как при общей трансдукции. Лизогенные трансдуктанты скорее представляют дупликацию генов, чем рекомбинацию, и поэтому не дают информации о нормальном расположении генов.
ВОПРОСЫ И ЗАДАЧИ
1. Последовательность передачи генов у различных Hfr-штаммов E. coli различна; для нескольких штаммов она представлена ниже. Постройте на основе этих данных физическую карту бактериального генома.
Hfr-штамм Последовательность передачи генов
1 АСЕ
2 D В Е
3 Е В D
4 С А D
2. Для определения взаимного расположения генов А, В, С и D на генетической карте использовали метод прерванной конъюгации. Hfr-штамм Leu+ А+, В+, С+, D+ Strs, передающий ген leu+ в самом начале скрещивания, скрещивали со штаммом F- leu- А-, В-, С-, D- Strr. Определите взаимное расположение генов А, В, С, D, используя гены strr и leu+ в качестве селективных маркеров.
Графическое представление результатов скрещивания:
|
З. Для определения взаимного расположения нескольких ауксотрофных мутаций E. coli проводили эксперимент по прерываемому скрещиванию между прототрофным штаммом Hfr Strs и штаммом F- А-, В-, D-, Strr. В качестве селективных маркеров использовали устойчивость к стрептомицину и прототрофность по D. Определите расположение генов А и В относительно D, считая, что D+ передается при скрещивании последним.
| Фенотип колоний D+ Strr | Доля колоний D+ Strr (%) |
| А+ В+ | |
| А- В+ | |
| А- В- | |
| А+ В- |
4. Для определения взаимного расположения нескольких ауксотрофных мутаций E. coli использовали данные по трансдукции фагом Р1. Проанализируйте приведенную таблицу и установите порядок следующих генов: A, D, G, E и F.
| Генотип донора | Генотип реципиента | Селективный маркер | Котрансдукция неселективного маркера дикого типа с селективным маркером (%) |
| A+ G+ | A- G- | A+ | |
| A+ D+ | A- D- | A+ | |
| A+ E+ | A- E- | A+ | |
| D+ E+ | D- E- | D+ | |
| D+ F+ | D- F- | D+ | |
| E+ F+ | E- F- | Е+ |
5. В таблице приводится порядок переноса различными Hfr-штаммами нескольких генов, расположенных неподалеку от точки начала (0). На основании этих данных постройте карту бактериальной хромосомы.
| Hfr-штамм | Порядок переноса генов |
| Н | 0-thr-leu~azi-ton-рго-lac-ade |
| 0-thi-met-ile-mtl-xyl-mal-str | |
| 0-ile-met-thi-thr-leu-azi-ton | |
| АВ311 | 0-his-trp-gal-ade-lac-pro-ton |
| АВ313 | 0-mtl-xyl-mal-str-his |
6. Студент получил задание определить положение на карте ауксотрофной мутации, которую он на основании данных по трансдукции считает тесно сцепленной с геном his. Он ставит конъюгационное скрещивание штамма Hfr АВ313 Strs, Ade- T1s с ауксотрофным штаммом F- Strr, Ade+ T1r. После прерывания конъюгации образцы суспензии он высевает на среду, содержащую глюкозу и стрептомицин. Рекомбинантов обнаруживается очень мало, и их недостаточно для того, чтобы установить тесное сцепление. Со своими трудностями он обращается к преподавателю. Тот советует ему исключить из среды стрептомицин и повторить эксперимент. Студент пользуется советом и получает надежные данные, показывающие, что ген, положение которого он должен определить, попадает в F- клетки за две минуты до гена his. Объясните, что было неправильно в первом эксперименте, и почему во втором случае эксперимент удался. Предложите другую схему эксперимента.
7. Для того чтобы определить положение гена arg7 на карте хромосомы E. coli, прототрофный штамм Strs Hfr4 (см. условие предыдущей задачи) скрещивали со штаммом F- Met- Mtl- Srtr Arg-. После того как скрещивание прерывалось, образцы культуры высевали на чашки, содержавшие глюкозу в качестве источника углерода, стрептомицин и аргинин (или метионин). По приведенным в таблице данным определите расположение гена arg7+.
| Время до прерывания скрещивания | Число рекомбинантов | |
| Arg+ Strr | Met+ Strr | |
| 11,5 | ||
| 14,5 |
8. Мутанты Thr- и Leu- у E.coli - ауксотрофы, требующие для роста треонин и лейцин, соответственно. Мутация ara3 обусловливает неспособность клеток использовать арабинозу в качестве источника углерода. В приводимой таблице указаны частоты котрансдукции этих генов фагом Р1. Какая селективная среда использовалась в каждом случае и какова последовательность генов?
| Генотип реципиента | Селективный маркер | Доля колоний, содержащих неселективный маркер (%) | ||
| leu+ | thr+ | ara+ | ||
| ara3 leu thr | thr+ | 4,1 | - | 6,7 |
| leu+ | - | 1,9 | 56,4 | |
| thr+ leu+ | - | - | 80,0 | |
| ara+ | 72,6 | 4,3 | - |
9. Мутации ara1 и ara2 очень тесно сцеплены с araЗ. Все они делают клетки E. coli неспособными к использованию арабинозы в качестве единственного источника углерода. Для того чтобы установить взаимное расположение этих мутаций, проводили реципрокные трансдукционные скрещивания, результаты которых представлены в таблице. Во всех случаях отбирали рекомбинанты Ara+ и среди них определяли долю носителей неселективных маркеров leu+ и thr+. Каково взаимное расположение этих маркеров?
| Реципиент | Донор | Доля колоний, содержащих неселективный маркер (%) | |
| leu+ | thr+ | ||
| thr ara1 leu | ara2 | 64,4 | 1,2 |
| thr ara2 leu | ara1 | 17,4 | 7,4 |
| thr ara1 leu | ara3 | 26,1 | 6,4 |
| thr ara3 leu | ara1 | 52,4 | 2,4 |
| thr ara2 leu | ara3 | 14,3 | 9,5 |
| thr ara3 leu | ara2 | 65,8 | 2,8 |
10. Когда в качестве реципиентных используются клетки ara3, а до-норными клетками для фага Р1 служат ara1, ara2 или клетки дикого типа, и отбираются рекомбинанты Ara+, то на селективной среде наряду с крупными колониями появляются крошечные колонии, неразличимые невооруженным глазом. Сформулируйте гипотезу об их происхождении.
11. Ниже приведены индексы котрансформации маркера hisB с рядом других близлежащих маркеров B. subtilis. На основании этих данных определите порядок расположения маркеров на генетической карте.
| Маркеры | Индекс котрансформации (г) |
| hisB – tyr1 | 0,77 |
| hisB – ara2 | 0,31 |
| hisB – ara1 | 0,57 |
| hisB – ara3 | 0,25 |
| hisB – trp2 | 0,53 |
12. Клетки некоторых штаммов Salmonella paratyphi подвижны, поскольку обладают жгутиками; клетки других штаммов лишены жгутиков и неспособны к самостоятельному движению. Фаг, осуществляющий общую трансдукцию у Salmonella (Р22), выращивают на подвижных клетках и инфицируют им неподвижные клетки. Когда инфицированные клетки неподвижного штамма высевают на поверхность столбика из мягкого агара, то после инкубации можно увидеть тянущиеся вглубь агара от поверхности цепочки мелких колоний. В культурах, выделенных из этих колоний, все клетки оказываются неподвижными. Объясните.
13. Проводили двухфакторные трансдукционные скрещивания у B. thuringiensis с помощью умеренного бактериофага ТР-13. По результатам, представленным в таблице, определите частоты котрансдукции исследуемых маркеров и их взаимное расположение.
| Генотип донора | Генотип реципиента | Число трансдуктантов с неселективным маркером | Общее число трансдуктантов |
| met1 | argC1 | ||
| met1 | argC1 | ||
| met1 | pyrA2 | ||
| argC1 | met1 | ||
| argC1 | met2 | ||
| argC1 | met1 | ||
| argC1 | met2 | ||
| argC1 | argC1 | ||
| met2 | argC1 | ||
| met2 | argC1 | ||
| met2 | pyrA2 | ||
| pyr1 | pyrA2 | ||
| pyr1 | met2 | ||
| pyr1 | met1 | ||
| pyr1 | argC1 | ||
| pyrA2 | met1 | ||
| pyrA2 | met2 |
14. Изобразите схематически рекомбинанты, которые могут быть выделены из нового F’штамма, в котором F'-элемент содержит гены thr+leu-, а бактериальная хромосома – гены thr-leu+. Обозначьте положение полового фактора в каждом рекомбинанте.
15. Предложите два способа определения того, принадлежит ли отобранная после скрещивания Hfr и F- рекомбинантная колония типу F' или F-.
16. Для определения порядка генов у B. thuringiensis проводили трехфакторные трансдукционные скрещивания посредством умеренных фагов ТР-13 и ТР-18. По полученным результатам, приведенным в таблице, определите взаимное расположение исследуемых маркеров.
| Генотип донора | Генотип реципиента | Фаг | Селекция | Рекомбинанты | |
| Класс | Количество | ||||
| lys2 trp2 | leu | ТР-13 | Leu+ | Leu+Lys-Trp- | |
| Leu+Lys+Trp+ | |||||
| Leu+Lys-Trp+ | |||||
| Leu+Lys+Trp- | |||||
| leu1 | lys2 trp2 | ТР-13 | Trp+ | Trp+Leu-Lys- | |
| Trp+Leu-Lys+ | |||||
| Trp+Leu+ Lys- | |||||
| Trp+Leu+ Lys+ | |||||
| leu2 lys1 | his1 | ТР-18 | His+ | Leu-His+Lys+ | |
| Leu-His+Lys- | |||||
| Leu+His+Lys- | |||||
| Leu+His+Lys+ | |||||
| his1 | leu2 lys1 | ТР-18 | Lys+ | Leu-His-Lys+ | |
| Leu+His-Lys+ | |||||
| Leu-His+Lys+ | |||||
| Leu+His+Lys+ | |||||
| cys1 | leu2 lys1 | ТР-18 | Lys+ | Leu+Lys+Cys- | |
| Leu+ Lys+Cys+ | |||||
| Leu-Lys+Cys- | |||||
| Leu-Lys+Cys+ |
17. При некоторых скрещиваниях с участием лизогенных штаммов профаги типа лямбда могут использоваться в качестве бактериального генетического маркера. В таблице представлены результаты скрещивания между нелизогенным (1у-) штаммом Hfr H Strs и штаммами F- Thr- Leu-Gal-Strr, лизогенными по одному из нескольких различных профагов, например, F- Thr-Leu-Gal-Strr(λ) (лябда). Отбираются рекомбинанты Thr+Leu+Strr и среди них определяют долю (1у-) Hfr. О наличии маркера 1у- судят по чувствительности к соответствующему фагу, другими словами, утрата профага рекомбинантом интерпретируется как наличие неселективного маркера. На основании этих данных определите взаимное расположение профагов на карте E.coli и их положение относительно Thr+Leu+ и Gal+.
| Профаг лямбда | Доля нелизогенных рекомбинантов | |
| Thr+Leu+Strr | Gal+Strr | |
| Лямбда | 0,16 | 0,82 |
| 0,01 | 0,10 | |
| 0,21 | 0,89 | |
| 0,11 | 0,68 | |
| <0,01 | 0,03 | |
| 0,025 | 0,15 |
18. В скрещивании использовали Hfr, гены которого передаются в следующем порядке: pur-arg-str. Отбирали рекомбинанты Рuг+ и Arg+, у которых затем определяли наличие других маркеров. Скрещивание проводили с целью картирования локуса 1аг. Получены следующие результаты:
| Селектор | Процент рекомбинантов, которые при проверке оказались | |||
| Pur+ | Arg+ | Lar+ | Strs | |
| Pur+ | 63,1 | 54,0 | 36,8 | |
| Arg+ | - | 64,8 | 44,1 |
Из приведенных результатов определите расположение гена 1аr по отношению к генам pur, arg и str.
19. Почему при конъюгации бактерий требуется разное время для образования рекомбинантов по разным маркерам?
20. Может ли клетка F- превратиться в клетку F+? Hfr? Каким образом?
21. Почему генетическая карта E.coli имеет кольцевую форму?
22. Что такое мерозигота? Что такое гетерогенота?
23. Возможна ли трансдукция с помощью литического (вирулентного) фага?
24. Чем и почему генетические карты различных штаммов Hfr E.coli отличаются друг от друга?
25. Можно ли исследовать комплементарное взаимодействие генов у бактерий? Если можно, то, каким образом?
26. В чем сходны и чем отличаются явления трансформации и трансдукции?
27. Установите генотипы следующих штаммов E. coli. Для обозначения генотипов используйте символы: pro+, pro, ade+, ade (не нуждается в пролине, ауксотроф по пролину, не нуждается в аденине, ауксотроф по аденину, соответственно).
| Штамм | Минимальная среда | Генотип | |||
| без добавок | с добавлением аденина | с добавлением пролина | с добавлением аденина и пролина | ||
| - | - | + | + | ||
| + | + | + | + | ||
| - | - | - | + | ||
| - | + | - | + |
28. При специализированной трансдукции штамма E. coli с генотипом gal- bio- бактериофагом λ, размноженным на штамме E. coli с генотипом gal+ bio+, на какой среде необходимо отбирать gal+ трансдуктанты без селекции по bio+?
29. Если необходимо получить рекомбинанты с генотипом leu+ str-r из скрещивания штамма Hfr leu+ str-s со штаммом F- leu- str-r, на какую среду необходимо высеять конъюгационную смесь?
30. Установите генотипы следующих штаммов E. coli. Для обозначения генотипов используйте символы: leu+, leu, thr+, thr (не нуждается в лейцине, ауксотроф по лейцину, не нуждается в треонине, ауксотроф по треонину, соответственно).
| Штамм | Минимальная среда | Генотип | |||
| без добавок | с добавлением треонина | с добавлением лейцина | с добавлением треонина и лейцина | ||
| - | - | - | + | ||
| - | + | - | + | ||
| + | + | + | + | ||
| - | - | + | + |
31. Проведено скрещивание штаммов E. coli Hfr H Strs (прототроф, чувствителен к стрептомицину) и F- Thr-Leu-Strr (ауксотроф по треонину и лейцину, устойчив к стрептомицину). Отобранные на соответствующей селективной среде рекомбинанты Thr+Strr или Leu+Strr по своему половому типу являются F-. Однако среди них могут находиться клоны F’. Каков механизм их возникновения? Как проверить, не является ли предназначенный для дальнейшей работы рекомбинантный клон F’?
32. Проведено скрещивание штамма E. coli proА recA rpsL ( ауксотроф по пролину, полностью подавлена способность осуществлять кроссинговер, устойчив к стрептомицину – фенотип Strr) с тремя типами прототрофных и чувствительных к стрептомицину донорных штаммов: F+, F’ proA+ и Hfr H. Сопоставьте результаты этих скрещиваний.
33. Для картирования генов leu2 (2 мин), proA (6 мин), lacZ (8 мин) и purE (12 мин) у E. coli методом прерывания конъюгации лучше всего использовать в качестве донора штамм Hfr H (прототроф, устойчивый к стрептомицину). Какой генотип должен иметь реципиентный штамм? Почему для контрселекции (подавления роста) клеток донорного штамма следует использовать стрептомицин (хромосомный ген устойчивости-чувствительности к стрептомицину rpsL, 72 мин)? Какие среды для выявления рекомбинантов следует приготовить? Как проводить отбор
34. При конъюгации у E. coli были установлены следующие последовательности передачи маркеров для донорных штаммов:
Hfr H: 0-thr-leu-proA-purE-trp-his;
Hfr C: 0-purE-proA-leu-thr-ilv-mal-rpsL;
Hfr KL19: 0-trp-his-tyrA-thy;
Hfr AB313: 0-mal-rpsL- thy-tyrA-his-trp;
Hfr PK191: 0-his-tyrA-thy-rpsl-mal-ilv;
Hfr KL14: 0-rpsL-mal-ilv-thr-leu-pro.
Постройте генетическую карту хромосомы E. coli.
35. При конъюгации у E. coli установлены последовательности передачи генетических маркеров для донорных штаммов:
Hfr B7: 0-purB-gal-lac-leu;
Hfr H: 0-leu-lac-gal-purB-his;
Hfr P10: 0-argE-rpsL-metC-tyrA-purC;
Hfr KL16: 0-tyrA-purC-his-man-purB-gal;
Hfr C: 0-lac-leu-argE-rpsL.
Постройте генетическую карту хромосомы E. coli.
ЛИТЕРАТУРА
Основная
Чемерилова В.И., Секерина О.А. Разрешающая способность генетического анализа и его особенности у бактерий: учеб пособие для самостоятельной работы студентов, обучающихся на специализациях «Генетика» и «Микробиология». – Иркутск ГОУ ВПО «Иркут.гос.ун-т», 2005. – 167 с., ил
Дополнительная
Айала Ф., Кайгер Дж. Современная генетика.-В 3-х т. Т. 1.-Пер.с англ.- М.:Мир, 1937.- С.227-259.
Жакоб Ф., Вольман Э. Пол и генетика бактерий.- М: Мир, 1962.
Захаров И.А., Мацелюх Б.П. Генетические карты микроорганизмов. -Л: Наука, 1979.- 158с.
Захаров И.А. Курс генетики микроорганизмов. - Мн.: Выш.шк., 1978,-192с.
Кушев В.В. Механизмы генетической рекомбинации.- Л: Наука, 1971.-С.33-36, 59-62.
Миллер Дж. Эксперименты в молекулярной генетике.- М.: Мир, 1976.-С.56-102, 253-291.
Прозоров А.А.Трансформация у бактерий.- М.: Наука, 1988.- 256 с.
Ратнер В.А. Молекулярная генетика: принципы и механизмы.-Новосибирск: Наука, 1983.- С.79-98
Стент Г., Кэлиндар Р. Молекулярная генетика.- М.:Мир, 1981.- гл.7, 9,
Редакционно-издательский отдел Иркутского государственного университета 664003, Иркутск, бульвар Гагарина,36
Государственный комитет по высшей школе Иркутский государственный университет
Дата добавления: 2015-02-07; просмотров: 3721;
