Картирование при трансформации
Картирование при трансформации как и при других аналогах полового процесса у бактерий, основано главным образом на анализе соотношения различных классов рекомбинантов при дифакторных и трехфакторных скрещиваниях.
Однако особенности трансформации накладывают свои ограничения на возможности картирования. Основная особенность связана с судьбой трансформирующей ДНК при поглощении ее клеткой и заключается в том, что с хромосомой реципиента взаимодействует одноцепочечный фрагмент хромосомы донора. Фрагментация последней происходит в процессе ее выделения и очистки, при адсорбции и поглощении; образование одноцепочечных участков также сопровождается фрагментацией. Кроме того, в синапсе участвует не весь фрагмент, а лишь часть его. В результате этих процессов при трансформации включается в геном реципиента фрагмент донора с молекулярной массой в среднем 2 мегадальтон (около 6000 п.н., 0,1% хромосомы). Для сравнения при трансдукции переносится двухцепочечная ДНК, составляющая 8-10% хромосомы донора и почти вся включается. Перенос больших фрагментов ДНК при трансформации определяет сущность картирования хромосомы – установление частоты рекомбинации и степени сцепления генетических маркеров на очень малых участках хромосомы в пределах расположения нескольких соседних генов.
Затрудняют построение генетических карт и другие особенности рекомбинации при трансформации: неравнозначность включения разных маркеров (эффект маркера), расхождение результатов реципрокных скрещиваний, состояние компетентности клеток реципиента, молекулярная структура ДНК донора и др.. Некоторые из этих трудностей можно преодолеть путем стандартизации методов выделения и очистки ДНК, методов получения компетентной культуры и условий при проведении опытов по трансформации.
Скрещивания при трансформации проводят путем обработки клеток-реципиентов препаратом очищенной ДНК, выделенной из клеток донора. Для отбора образующихся рекомбинантов (трансформантов) из массы нетрансформированных клеток необходимо различие донора и реципиента по удобному селективному маркеру.
Например (рис.18): выделяем ДНК из устойчивых к стрептомицину клеток и обрабатываем препаратом ДНК клетки с фенотипом Strs (чувствительность к стрептомицину).
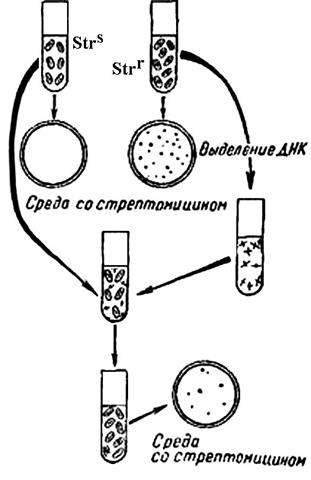
|
Рис. 18. Схема опыта по трансформации.
Компетентная клетка может поглотить фрагмент донорной ДНК, несущий ген strr. При включении этого гена в геном реципиентной клетки она станет устойчивой к антибиотику. Из популяции Strs клеток ее можно отселектировать на среде, содержащей стрептомицин, на которой не будут размножаться все нетрансформированные клетки, а трансформированная образует клон. Устойчивость к стрептомицину – селективный маркер. Частота трансформации равна отношению числа трансформантов к числу реципиентных клеток.
С помощью однофакторного скрещивания можно определить эффективность, с которой исследуемый маркер интегрируется в хромосому реципиента. Для стандартизации результатов повторных опытов, зависящих от свойств культуры реципиента и качества препаратов ДНК донора, параллельно проводят учет частоты трансформантов по, так называемому, несцепленному стандартному маркеру, расположенному на том же или другом фрагменте трансформирующей ДНК. Эффективность интеграции изучаемого маркера выражают отношением частоты рекомбинации к частоте трансформации по стандартному гену.
В двухфакторном скрещивании наряду с одиночными трансформантами, включившими один маркер донора, можно выделить двойные трансформанты, получившие от донора два маркера одновременно (рис. 19).
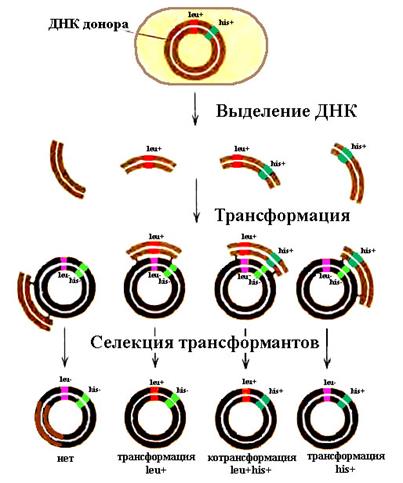
|
Рис. 19. Дифакторное скрещивание.
Например: выделяем ДНК из клеток донора с фенотипом Leu+His+ и трансформируем клетки реципиента Leu-His-. Путем высева обработанных трансформирующей ДНК клеток-реципиентов на среду без лейцина, но с гистидином, можно отселектировать одиночные трансформанты с фенотипом Leu+ (селективный маркер). Если клетки реципиента, обработанные трансформирующей ДНК, высеять на среду с лейцином и без гистидина, то отселектируем трансформанты с фенотипом His+ (селективный маркер). Перепечатав выделенные колонии трансформантов на среду без лейцина и гистидина, среди одиночных трансформантов Leu+His- и Leu-His+ можно обнаружить двойные трансформанты Leu+His+. В этом примере один из признаков является селективным и служит для выделения трансформантов, а второй – неселективным маркером, который используют для определения частоты совместного переноса или, так называемой, котрансформации.
Частота котрансформации – r (индекс одновременного переноса) определяется отношением числа двойных трансформантов к сумме всех трансформантов (одиночных и двойных).
Для трансформации АВ- х аb он будет равен:
r = АВ / АВ+Аb+аВ, где АВ – частота двойных трансформантов, Аb и аВ – частоты одиночных трансформантов. На практике определяется не частота одиночных трансформантов, а трансформантов, получивших признак А (АВ и Аb) или В (АВ и аВ). Индекс котрансформации рассчитывают в этом случае так:
r= АВ/А+В-АВ.
Пример:
| Фенотип | Число трансформантов на 103 клеток реципиента | |||
| донора | реципиента | |||
| Ind+ Leu+ | Ind- Leu- | Ind+ | Leu+ | Ind+ Leu+ 0,8 |
| Ind+ His+ | Ind-His- | Ind+ | His+ | Ind+His+ |
r (ind-leu) = 0,00008 / 0,0050 + 0,0100 - 0,00008 = 0,005
r (ind-his) = 0,0048 / 0,0070 + 0,0072 - 0,0048 = 0,51
Видно, что маркеры ind и leu переносятся совместно очень редко, а маркеры ind и his переносятся вместе с высокой частотой. Естественно предполагать сцепление последних, т.е. локализацию их на одном фрагменте.
Котрансформация является главным критерием сцепления маркеров при трансформации, а частота совместной передачи маркеров, лежащих на одном фрагменте, служит средством измерения расстояния между ними. Чем чаще происходит их совместная передача, тем ближе они находятся друг к другу.
Однако совместная передача признаков при трансформации может быть обусловлена не только сцеплением маркеров, но и явлением, получившим название – конгрессия.
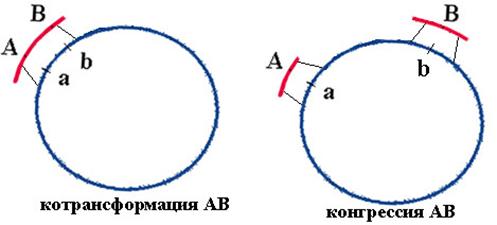
|
Конгрессией называется одновременная передача заведомо несцепленных маркеров при трансформации, вызванная одновременным и независимым поглощением двух или более фрагментов ДНК одной и той же клеткой. Эта единовременность создает видимость физического сцепления при включении. Величины сцепления отдельных маркеров при конгрессии сильно варьируют и зависят от целостности хромосомы. Поэтому такое сцепление называется нестабильным или мягким. Использование его в картировании приводит к ошибкам. Вообще сцепление маркеров при трансформации не превышающее 10% совместного переноса при дифакторном скрещивании может быть артефактом, вызываемым конгрессией (например, r = 0,005 в вышеприведенном примере).
Для того чтобы отличить конгрессию от истинного сцепления, проверяют результаты совместной передачи двух маркеров при различной концентрации ДНК в области ненасыщения (эффект разбавления ДНК). Если при снижении концентрации частота появления двойных трансформантов резко падает, то это означает, что между маркерами на самом деле физического сцепления нет.
Пример:
| Концентрация ДНК (мкг/мл) | Число трансформантов | |||
| His+ | Thr+ | |||
| всего | из них RecH | всего | из них RecH | |
| 13,5 | ||||
| 6,7 | ||||
| 3,3 | ||||
| 1,6 | ||||
| 0,8 |
Из результатов таблицы видно, что между маркерами His+ и RecH сцепление отсутствует, а между маркерами Thr+ и RecН оно истинное.
Результаты определения степени сцепления маркеров зависят от многих причин, но главным образом от состояния трансформирующей ДНК. Чем целее ДНК, тем больше до известной степени процент совместного переноса двух маркеров и тем меньше будут выглядеть расстояния между ними. Фрагментация ДНК, накладываясь на частоту собственно рекомбинации, «расширяет карту». Из-за рекомбинационных событий, а также из-за повреждений ДНК при ее вхождении в клетку, стопроцентного совместного включения не происходит. Чем больше удалены друг от друга маркеры, расположенные на одном и том же фрагменте, тем больше вероятность, что при дифакторном скрещивании они будут разъединены. Трансформационные скрещивания вполне пригодны для составления генетических карт на участках хромосом, не превышающих 10-15 кб (несколько меньше 1% хромосомы).
Трансформация не требует половой дифференцировки партнеров, нужной для конъюгации. Она предоставляет возможность проводить реципрокные скрещивания по одной, двум и трем точкам.
Трехфакторное скрещивание между одинарным и двойным мутантом, имеющим повреждения в одной группе сцепления, является единственным критерием для правильного размещения маркеров на карте хромосомы.
В скрещивании определяют следующие параметры: число жизнеспособных клеток реципиента, концентрацию ДНК донора, число трансформантов по селективному маркеру, число трансформантов, унаследовавших неселективный маркер.
Выбор одной из возможных последовательностей генов основывается вновь на общих закономерностях: 1) чем ближе неселективный маркер к селективным, тем меньше частота кроссинговера между ними; 2) четырехкратный кроссинговер происходит реже, чем двойной.
Пример: донор Gua+ Dna+ Pac-
реципиент Gua- Dna- Pac+
| Фенотип трансформантов | Селектируемый маркер и число трансформантов | |
| Gua+ | Dna+ | |
| Gua+ Dna+ Pac- | ||
| Gua+ Dna- Pac- | - | |
| Gua+ Dna+ Pac+ | ||
| Gua+ Dna- Pac+ | - | |
| Gua- Dna+ Pac- | - | |
| Gua- Dna+ Pac+ | - | |
| Всего |
Частота котрансформации: Gua+Рас – 7/107 = 0,065 (6,5%)
Gua+Dna+ – 50/107 = 0,47 (47%),
–36/96 = 0,38 (38%)
Dna+Рас- – 11/96 = 0,11 (11%).
Установленный порядок gua–dna–…–рас.
Как видно, для образования почти всех генотипов трансформантов необходимо два перекреста и лишь для возникновения одного с фенотипом Dna-Рас- требуется четыре. Этот тип трансформантов называется критическим. С таким фенотипом выделен всего один трансформант, что свидетельствует о соблюдении критерия минимума множественных кроссинговеров.
Дата добавления: 2015-02-07; просмотров: 3070;
