Конъюгация. Общая характеристика процесса
Конъюгация – это направленный перенос генетического материала из клеток-донора в клетки-реципиенты при непосредственном физическом контакте между ними.
Данный способ обмена генетической информацией был обнаружен в 1946 году Д.Ледербергом и Е.Татумом у E. coli и в дальнейшем у многих других грамположительных и грамотрицательных видов бактерий.
Способность быть донором у бактерий определяется конъюгативными плазмидами (эписомами), которые могут находиться в клетке во внехромосомном состоянии и реплицироваться автономно, либо включаться в хромосому бактерий и реплицироваться вместе с ней. Среди них наиболее тщательно изучена эписома E. coli, получившая название полового или F-фактора (фактора фертильности).
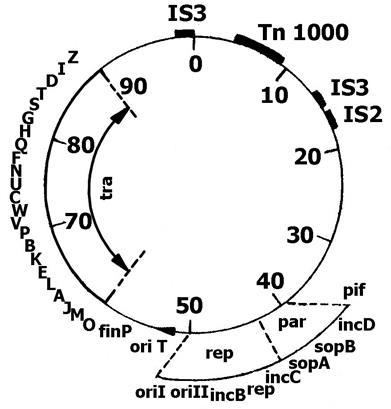
Половой фактор E. coli представляет собой кольцевую суперспирализованную молекулу ДНК, размером 94,5 т.п.н. В процессе роста клеток эта ДНК реплицируется по тета-типу, также как бактериальная хромосома и одновременно с ней (т.е. находится под строгим контролем репликации). На рис.6 приведена генетическая карта F-фактора E. coli.
За конъюгативные свойства F-фактора отвечает оперон tra (от англ. transfer – перенос), который включает более 20 генов и занимает одну треть ее ДНК.
|
Рис.6. Генетическая карта F-фактора E. coli
Гены tra-оперона отвечают: 1) за образование на поверхности клеток белковых половых ворсинок – F-пилей, с помощью которых происходит первичный контакт клеток донора и реципиента (гены от traА до traG); 2) за синтез веществ, изменяющих антигенный состав клеточной стенки и ее поверхностный заряд (гены traТ и traS), что сводит к минимуму спаривание клеток донора между собой (явление поверхностного исключения); 3) за конъюгативный перенос эписомы или хромосомы донора в реципиентные клетки (гены traМDIZ). Это осуществляется путем введения однонитевого разрыва (ника) в двухцепочечной ДНК эписомы в сайте oriT и перемещения одной нити с 5'-конца в реципиентную клетку так, что оперон tra передается последним (рис. 7); 4) за позитивную регуляцию генов оперона (traJ). У многих F-подобных плазмид экспрессия генов оперона подавляется репрессором, две субъединицы которого кодируются генами finO и finP. Репрессор действует на оператор traО гена traJ и предотвращает синтез его продукта, блокируя тем самым экспрессию всего оперона tra. Оперон tra F-фактора не репрессируется, так как на нем нет гена traО. Если в клетке одновременно находится F-фактор и F-подобная плазмида, то продукт гена traО образует с продуктом гена traР репрессор и ее оперон подавляется.
В области 40-50 т.п.н. F-фактора располагаются гены, ответственные за вегетативную репликацию и распределение копий ДНК по дочерним клеткам (области rep и par). Контроль несовместимости родственных плазмид осуществляется генами incВ и incС, блокирующих репликацию эписомной ДНК. Ген incD блокирует распределение копий ДНК. Ген pif исключает развитие в клетке фагов ТЗ и Т7.
Попадая в клетки, эта эписома изменяет их фенотипические свойства. Клетки E.coli, содержащие половой фактор, обозначают как F+, а не имеющие его – как F-. F+ клетки в отличие от F- приобретают небольшое число половых ворсинок-пилей и одновременно чувствительность к нитевидным фагам МS2, f1 и f2 (пили являются рецепторами для данных фагов). Они также становятся донорами эписомной ДНК, перестают поддерживать развитие фагов ТЗ и Т7. При конъюгации таких клеток блокируется проникновение в них донорной ДНК.
При совместном культивировании клетки F+ и F- вступают в контакт за счет того, что F-пили донорных клеток соединяются с соответствующими рецепторами на поверхности клеток-реципиентов, которыми могут быть только F- клетки. Далее происходит сокращение пилей и между клетками создается цитоплазматический конъюгационный мостик или канал. Спаривание клеток может произойти по концам, по боковым поверхностям и между концом и боковой поверхностью клетки.
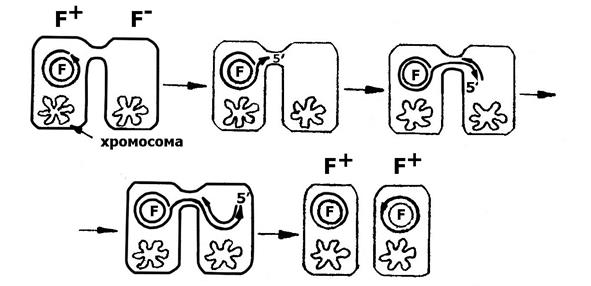
Контакт между F+ и F-клетками является сигналом для расщепления одной нити ДНК фактора и перехода его к репликации по сигма-типу (σ или «катящегося кольца»). 5'-одноцепочечный конец реплицирующегося фактора проникает в реципиентную клетку и там синтезируется комплементарная цепь. Репликация ДНК F-фактора приводит к переносу копии F-фактора в F- клетки, превращая их в F+ клетки. В донорной клетке остается копия F-фактора (рис.7). В популяции F+ каждая клетка способна передавать половой фактор клетке-реципиенту. Поэтому его передача происходит с высокой частотой. За один час контакта 90% клеток становится донорами.
Лишь небольшая часть (1 среди 104) клеток этой популяции передает реципиентам хромосомную ДНК. Возникновение таких клеток связано со спонтанной интеграцией ДНК F-фактора в бактериальную хромосому, происходящей с частотой 10-7.
|
Рис.7. Перенос полового фактора в процессе репликации по типу «катящегося кольца».
Структурными элементами, обеспечивающими интеграцию F-фактора в бактериальную хромосому, являются транспозиционные элементы IS2, IS3 и Тn 1000, входящие в состав эписомной ДНК. Они взаимодействуют с гомологичными элементами бактериальной ДНК через механизм сайт-специфической или общей рекомбинации и встраиваются в нее в 25-30 разных мест и в разной ориентации в зависимости от локализации и направления бактериальных транспозонных элементов (рис.8, А).
Клетка F+ после интеграции фактора в хромосому приобретает способность с высокой частотой ориентированно передавать ее в F- клетки (рис.8, Б). Такие клетки получили название Hfr (от англ. high frequency recombination – высокая частота рекомбинации). Если из популяции F+ выделить и очистить такие Hfr клетки, то в этом случае свою хромосому будет передавать каждая клетка, и популяция в целом будет обладать высокой частотой (более 1 на 102) переноса по сравнению с популяцией F+.
Перенос осуществляется с помощью интегрированного F-фактора. Контакт между донорными Hfr клетками и F- реципиентами инициирует репликацию с oriТ интегрированного фактора по типу «катящегося кольца». Эта репликация приводит к последовательному переносу вначале небольшого фрагмента F-фактора, затем следующей за ним бактериальной хромосомы и последним передается оставшаяся часть фактора с генами tra оперона.
А 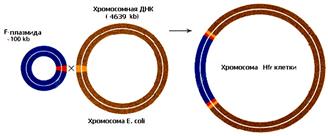 Б
Б 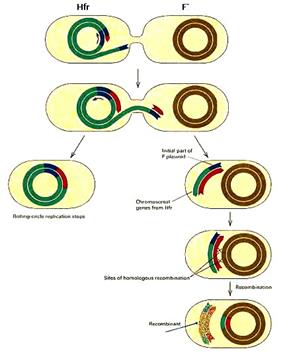
|
Рис.8. Образование Hfr-клеток (А) и перенос бактериальной хромосомы с помощью интегрированного полового фактора (Б).
Средняя скорость переноса более 30 т.п.н. в минуту. Поступление бактериальных генов из Hfr в F- клетку происходит последовательно, всегда начиная с сайта интеграции F-фактора (рис.8, Б). Так как у разных штаммов Hfr фактор может встраиваться в разные сайты и в разной ориентации, то они будут отличаться между собой началом и порядком переноса генов бактериальной хромосомы. Для того чтобы в клетку F- попала конечная часть фактора, необходимо, чтобы в нее перешла вся хромосома донора Hfr. Это случается очень редко из-за спонтанных разрывов конъюгационного мостика. Обычно передается около 15-20% хромосомы Hfr. Поэтому реципиентные клетки редко становятся донорами Hfr в скрещиваниях типа Hfr х F-. Вся хромосома E. coli переносится при 37°C за 90 минут контакта.
Когда копия хромосомы донора попадает в клетку-реципиент, становится возможной рекомбинация между ней и хромосомой реципиента; Возникновение рекомбинантов определяется исключительно жизнеспособностью реципиентных клеток.
Дата добавления: 2015-02-07; просмотров: 7075;
