Метод Тенфорда определения разности свободной энергии денатурированного и нативного белка по денатурации в растворе мочевины
Для изменения свободной энергии денатурации белка в растворе мочевины можно записать:
−ΔFu = RTlnKu = RTln 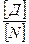 , где
, где 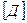 и
и 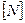 − концентрации денатурированного и нативного белка.
− концентрации денатурированного и нативного белка.
δ(ΔF) = ΔFu - ΔFH 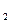 O = ΔFД – ΔFN.
O = ΔFД – ΔFN.
δ(ΔF) = 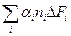 .
.
ni – число групп (звеньев) типа i в белке.
αi – численный параметр, зависящий от степени доступности растворителю групп данного типа в нативной конформации.
ΔFi – вклад групп типа i в свободную энергию перехода.
αi (пептидн.) 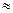 0.5;
0.5;
αi (полярн.) 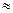 0.25;
0.25;
αi (гидроф.) 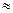 0.75;
0.75;
ΔFi определяется из данных о растворимости аминокислот в воде и в растворе мочевины данной концентрации. Для концентрации мочевины (C 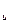 ), при которой [Д] = [N] (ΔFu = 0), тогда
), при которой [Д] = [N] (ΔFu = 0), тогда
ΔFH 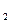 O =− δ(ΔF)
O =− δ(ΔF) 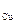 =−
=− 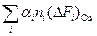 .
.
3.32. Калориметрические измерения денатурационных изменений в белках
Денатурацию рассматривают как мономолекулярную реакцию перехода из нативного состояния белка (N) в денатурированное (Д):
N←→ Д
В калориметрии измеряют ΔН или ΔСр, сопровождающие эти переходы. В соответствии с формулой Киргоффа изменение энтальпии при плавлении:
ΔН = 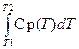 , где Cp(T) − теплоёмкость при постоянном давлении.
, где Cp(T) − теплоёмкость при постоянном давлении.
В обычных измерениях подводят теплоту к образцу: 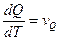 и регистрируют скорость повышения температуры образца
и регистрируют скорость повышения температуры образца 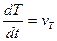 (
( 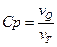 ).
).
Чувствительность микрокалориметров высокая, примерно 10-7 Вт.
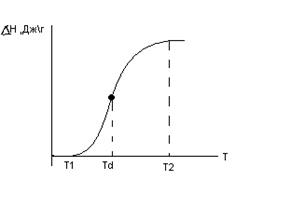
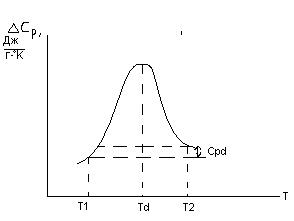
ΔСpd – это разность теплоемкостей белка в нативном и денатурированном состояниях при температуре перехода Td.
ΔНден = 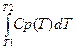 -
- 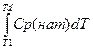 -
- 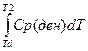 = ΔНd -
= ΔНd - 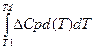 ,
,
где ΔНd − молярная энтальпия перехода.
Для энтропии:
ΔSден = 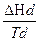 -
- 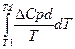 .
.
Свободная энергия Гиббса для процесса денатурации (ΔFден ) запишется в виде:
ΔFден = ΔНден - T1 ΔSден = ΔНd 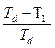 -
- 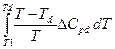 .
.
Дата добавления: 2015-02-07; просмотров: 1093;
