На скорость химической реакции оказывает влияние природе металла. А влияет ли на скорость реакции аналогично и ирнрола второго реагента — кислоты?
Проделаем второй опыт. Опустим в пробирки по одной грануле цинка и прильем в первую — 2 мл уксусной кислоты, а во вторую — 2 мл соляной кислоты одинаковой молярной концентрации. Нетрудно заметить, что скорость реакции взаимодействия цинка с соляной кислотой выше, чем скорость взаимодействия цинка с уксусной кислотой.
Влияние природы веществ на скорость химических реакций очень велико. Например, процесс превращения гранита в глину, тек называемое выветривание горных пород, протекает на протяжении тысячелетий. Природа бутылочного или оконного стекла, полиэтилена и других веществ, созданных человеком, такова, что эти вещества практически не разлагаются или разлагаются чрезвычайно медленно.
Вот и приходится человеку находить способы их утилизации, например сжигать. И как мудро распорядилась эволюция, когда предусмотрела для человека и большинства животных в качестве транспортирующего кислород вещества гемоглобин крови, который уже при комнатной температуре способен соединяться с кислородом воздуха со значительной скоростью, а следовательно, и быстро доставлять его из легких в тканях.
Слелующим важнейшим фактором, влияющим на скорость химической реакции, является концентрация {содержание) реагирующих веществ.
Проделаем опыт, показывающий это влияние. Нальем в три пробирки раствор тиосульфата натрия, который ребятам, занимающимся фотографией, известен иод названием фиксажа. В первую пробирку — 3 мл. во вторую — 2 мл и в третью — 1 мл. Затем прильем во все пробирки воды так, чтобы уровень растворов тиосульфата в них стал одинаковым — 5 мл. то есть в первую пробирку прильем 2 мл воды, во вторую — 3 мл. а в третью — 4 мл.
Понятно, что наибольшей будет концентрация раствора тиосульфата н первой пробирке, а наименьшей — в третьей. Теперь быстро прильем в каждую пробирку (начиная с третьей) по 2 мл раствора серной кислоты и проследим, в какой из них раньше всего выпадет осадок серы. Раньше всего он образуется там. где выше концентрация тиосульфата, то есть в первой пробирке. Это и понятно. Ведь для химического взаимодействия серной кислоты и тиосульфата необходимо, чтобы частички (ионы), из которых они состоят, столкнулись. Чем больше число столкновений, тем быстрее протекает реакция. А число столкновений тем больше, чем больше концентрация реагирующих веществ, то есть количества, или массы, этих веществ в единице объема.
На основании обширного экспериментального материала в 1867 г. норвежские ученые К. Гульдберг и П. Вааге сформулировали основной химической кинетики, который устанавливал зависимость скорости химической реакции от концентрации реагирующих веществ.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам.
Скорость простой (злементарной), протекающей в одну стадию реакции и записанной в общей форме
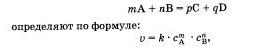
где v — скорость реакции, C A — молярная концентрация вещества А, C B — молярная концентрация вещества В, m n их коэффициенты, а k — константа, которая равна скорости реакции при концентрации реагирующих веществ 1 моль/л (справочная величина).
Этот закон называют также законом действующих масс. Он не распространяется на вещества, находящиеся в твердом состоянии, так как считается, что их концентрация постоянна, нескольку они реагируют лишь на поверхности, которая, как считается, остается практически неизменной (гетерогенная реакция).
Например, рассмотрим реакцию взаимодействия меди с кислородом:
2Сu + О2 = 2СuО.
Скорость этой реакции пропорциональна концентрации кислорода, так как соударения можду молекулами кислорода и меди могут происходить только на поверхности раздела веществ, а значит, масса меди не влияет на скорость реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант Гоффе (1884):
При повышении температуры на каждые 10° С скорость реакции увеличивается в 2—1 раза.
Впервые в истории науки Вант-Гоффу была вручена Нобелевская прения по химии.
Взаимнодействие водорода и кислороде при комнатной температуре почти не происходит - так мала скорость реакции. При 500 °С эта реакция протекает всего эа 50 мин. а при 700 °С она происходит почти мгновенно:
H2+O2 = 2H2O
Математически правило Вант-Гоффа записывается следующей формулой:
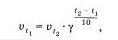
Правило ВантГоффа является приближенным и применяется лишь для ориентировочной оценки влияния температуры на скорость реакции. Згу зависимость также легко проверить опытным путем. Нальем н три химических стаканчика одинаковые объемы раствора тиосульфата натрия. Одинаковые растворы серной кислоты, которые мы одновременно будем приливать в эти стаканчики ні трех пробирок, нагреем до разных температур: в первой пробирке оставим раствор комнатной температуры: вторую пробирку нагреем до 40 °С. а третью -до 70 °С. Нетрудно заметить, что вначале помутнеет раствор тиосульфата, к которому прилили самый горячий раствор кислоты, потом — теплый в. наконец. — раствор тиосульфата натрии, к которому придали раствор серной кислоты комнатной температуры.
Итак, мы выяснили, что скорость химической реакции зависит от следующих факторов: от природы реагирующих веществ, концентрации, температуры, площади соприкосновения реагирующих веществ (для гетерогенных реакций).
действующих масс), 3. Зависимость скорости химической реакции от температуры — правило Ваит-Гоффа.
Дата добавления: 2015-01-10; просмотров: 2596;
