Способы получения солей
Рассмотрим важнейшие способы получения солей.
1. Реакция нейтрализации. Этот способ уже неоднократно встречался в предыдущих параграфах. Растворы кислоты и основания смешивают (осторожно!) в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например:
| H2SO4 | + | 2 KOH | = | K2SO4 | + | 2 H2O |
| сульфат калия |
 2. Реакция кислот с основными оксидами. Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например:
2. Реакция кислот с основными оксидами. Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например:
| H2SO4 | + | CuO | = | CuSO4 | + | H2O |
| сульфат меди |
3. Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации:
| Ca(OH)2 | + | CO2 | = | CaCO3↓ | + | H2O |
| карбонат кальция |
 Если пропускать в раствор избыток СО2, то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО3)2:
Если пропускать в раствор избыток СО2, то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО3)2:
СаСО3 + Н2СО3 = Са(НСО3)2 (раствор)
4. Реакция основных и кислотных оксидов между собой:
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
 5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
| H2S | + | CuCl2 | = | CuS↓ (осадок) | + | 2 HCl |
| сульфид меди |
6. Реакция оснований с солями. Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например:
| 3 NaOH | + | FeCl3 | = | Fe(OH)3↓ | + | 3 NaCl |
| (осадок) | хлорид натрия |
 7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
| AgNO3 | + | KCl | = | AgCl↓ (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl- + K+ + Br-
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8. Реакция металлов с кислотами. В способах 1 – 7 мы имели дело с реакциями обмена (только способ 4 – реакция соединения. Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 8-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли:
| Fe | + | H2SO4(разб.) | = | FeSO4 | + | H2 |
| сульфат железа II |
 9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым":
9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым":
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
 10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 |
| порошок меди | сульфат цинка |
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле СnН2n+2.
В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28'
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму. В развернутом состоянии такие молекулы имеют зигзагообразную форму с углами при атомах углерода, близких к тетраэдрическому (109°280, например в молекуле н-пентана.
Особо стоит напомнить о связях, при помощи которых построены молекулы алканов. Все связи в молекулах алканов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это Þ-связи. Связи углерод—углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм. Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан.
Основы номенклатуры ИЮПАК уже обсуждались. В этой части параграфа она будет рассмотрена подробнее для алканов.
1. Выбор главной цепи
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: летил (—СН3), затем пропил (—СН2—СН2—СН3), этил (—СН2—СН3) и т. д.Обратите внимание, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
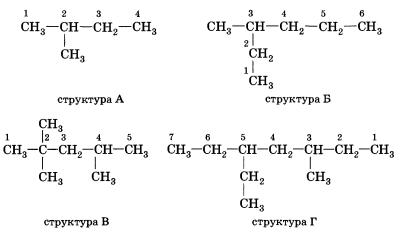
Названия веществ, структурные формулы которых приведены выше, следующие:
структура А 2-метилбутан
структура Б З-метилгексан
структура В 2,2,4-тприметилпентап
структура Г З-метил-5-этилтептан
Получение
1. Выделение углеводородов из природного сырья. Источниками предельных углеводородов, как вы уже знаете, являются нефть и природный газ.
Основной компонент природного газа — простейший углеводород метан, который используется непосредственно или подвергается переработке.
Нефть, извлеченная из земных недр, также подвергается переработке, ректификации, крекингу.
Больше всего углеводородов получают при переработке нефти и других природных источников. Но значительное количество ценных углеводородов получают искусственно, синтетическими способами.
2. Изомеризация.Наличие катализаторов изомеризации ускоряет образование углеводородов с разветвленным скелетом из линейных углеводородов:
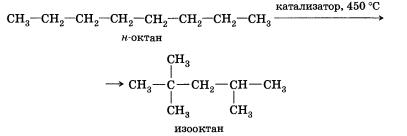
Добавление катализаторов позволяет несколько уменьшить температуру, при которой протекает реакция.
3. Гидрирование (присоединение водорода) алкенов. Как уже было сказано, в результате крекинга образуется большое количество непредельных углеводородов с двойной связью — алкенов. Уменьшить их количество можно, добавив в систему водород и катализаторы гидрирования — металлы (платина, палладий, никель):
СН3 - СН2 - СН = СН2 + Н2 -> СН3 - СН2 - СН2 - СН3
Крекинг в присутствии катализаторов гидрирования с добавлением водорода называется восстановительным крекингом. Основными его продуктами являются предельные углеводороды.
В заключение добавим, что повышение давления при крекинге (крекинг высокого давления) позволяет уменьшить количество газообразных (СН4—С4Н10) углеводородов и повысить содержание жидких углеводородов с длиной цепи 6—10 атомов углерода, которые составляют основу бензинов.
Мы рассмотрели несколько промышленных способов получения алканов, которые являются основой промышленной переработки основного углеводородного сырья — нефти.
Теперь обсудим несколько лабораторных способов получения алканов.
4. Декарбоксилирование натриевых солей карбоновых кислот.
Нагревание натриевой соли уксусной кислоты (ацетата натрия) с избытком щелочи приводит к отщеплению карбоксильной группы и образованию метана:
СН3СОNа + NаОН СН4 + Nа2С03
Если вместо ацетата натрия взять пропионат натрия, то образуется этан, из бутаноата натрия — пропан и т. д.
RСН2СОNа +NаОН -> RСН3 + Nа2С03
5. Синтез Вюрца. При взаимодействии галогеналканов с щелочным металлом натрием образуются предельные углеводороды и галогенид щелочного металла, например:
2СН3СН2Вг + 2Nа —»>СН3СН2СН2СН3 + 2NаВг
Действие щелочного металла на смесь галогенуглеводородов (например, бромэтана и бромметана) приведет к образованию смеси алканов (этана, пропана и бутана).
Реакция, на которой основан синтез Вюрца, хорошо протекает только с галогеналканами, в молекулах которых атом галогена присоединен к первичному атому углерода.
6. Гидролиз карбидов. При обработке некоторых карбидов, содержащих углерод в степени окисления -4 (например, карбида алюминия), водой образуется метан:
Аl4С3 + 12Н20 = ЗСН4 + 4Аl(ОН)3 Физические свойства
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который надо звонить по телефону 04, определяется запахом меркаптанов — серусодер-жащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С5Н12 до С15Н32 — жидкости, более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства
1. Реакции замещения. Наиболее характерными для ал-канов являются реакции свободнорадикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
СН4 + С12 —> СН3Сl + HCl
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
СН3Сl + С12 —> HCl + СН2Сl2
дихлорметан хлористый метилен
СН2Сl2 + Сl2 —> HCl + CHCl3
трихлорметан хлороформ
СНСl3 + Сl2 —> HCl + ССl4
тетрахлорметан четыреххлористый углерод
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). При пропускании алканов над катализатором (Pt, Ni, А1203, Сг2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:
СН3—СН3 —> СН2=СН2 + Н2
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнора-дикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива.
СН4 + 2O2 —> С02 + 2Н2O + 880кДж
В общем виде реакцию горения алканов можно записать следующим образом:

Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества. При нагревании до температуры 1500 °С возможно образование ацетилена.
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
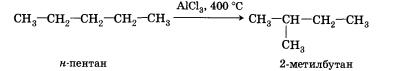
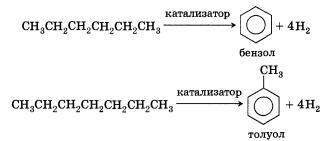
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод—углерод) связей и слабополярных С—Н (углерод—водород) связей. В них нет участков с повышенной и пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних воздействий (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, так как связи в молекулах алканов не разрываются по гетеролитическому механизму.Наиболее характерными реакциями алканов являются реакции свободнорадикального замещения. В ходе этих реакций атом водорода замещается на атом галогена или какую-либо группу.
Кинетику и механизм свободнорадикальных цепных реакций, т. е. реакций, протекающих под действием свободных радикалов — частиц, имеющих неспаренные электроны, — изучал замечательный русский химик Н. Н. Семенов. Именно за эти исследования ему была присуждена Нобелевская премия по химии.
Обычно механизм реакции свободнорадикального замещения представляют тремя основными стадиями:
1. Инициирование (зарождение цепи, образование свободных радикалов под действием источника энергии — ультрафиолетового света, нагревания).
2. Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые радикалы и новые молекулы).
3. Обрыв цепи (объединение свободных радикалов в неактивные молекулы (рекомбинация), «гибель» радикалов, прекращение развития цепи реакций).
Семенов Николай Николаевич
(1896 - 1986)Советский физик и физикохимик, академик. Лауреат Нобелевской премии (1956). Научные исследования относятся к учению о химических процессах, катализе, цепных реакциях, теории теплового взрыва и горении газовых смесей.
Рассмотрим этот механизм на примере реакции хлорирования метана:
СН4 + Сl2 —> СН3Сl + НСl
Инициирование цепи происходит в результате того, что под действием ультрафиолетового облучения или при нагревании происходит гомолитический разрыв связи Сl—Сl и молекула хлора распадается на атомы:
Сl: Сl —> Сl· + Сl·
Образовавшиеся свободные радикалы атакуют молекулы метана, отрывая у них атом водорода:
СН4 + Сl· —> СН3· + НСl
и превращая в радикалы СН3·, которые, в свою очередь, сталкиваясь с молекулами хлора, разрушают их с образованием новых радикалов:
СН3· + Сl2 —> СН3Сl + Сl· и т. д.
Происходит развитие цепи.
Наряду с образованием радикалов происходит их «гибель» в результате процесса рекомбинации — образования неактивной молекулы из двух радикалов:
СН3· + Сl· —> СН3Сl
Сl· + Сl· —> Сl2
СН3· + СН3· —> СН3—СН3
Интересно отметить, что при рекомбинации выделяется ровно столько энергии, сколько необходимо для разрушения только что образовавшейся связи. В связи с этим рекомбинация возможна только в том случае, если в соударении двух радикалов участвует третья частица (другая молекула, стенка реакционного сосуда), которая забирает на себя избыток энергии. Это дает возможность регулировать и даже останавливать свободнорадикальные цепные реакции.Обратите внимание на последний пример реакции рекомбинации — образование молекулы этана. Этот пример показывает, что реакция с участием органических соединений представляет собой достаточно сложный процесс, в результате которого, наряду с основным продуктом реакции, очень часто образуются побочные продукты, что приводит к необходимости разрабатывать сложные и дорогостоящие методики очистки и выделения целевых веществ.
В реакционной смеси, полученной при хлорировании метана, наряду с хлорметаном (СН3Сl) и хлороводородом, будут содержаться: дихлорметан (СН2Сl2), трихлорметан (СНСl3), тетрахлорметан (ССl4), этан и продукты его хлорирования.
Теперь попытаемся рассмотреть реакцию галогенирования (например, бромирования) более сложного органического соединения — пропана.
Если в случае хлорирования метана возможно только одно моно-хлорпроизводное, то в этой реакции может образоваться уже два монобромпроизводных:
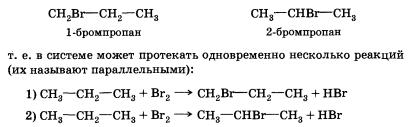
Видно, что в первом случае происходит замещение атома водорода при первичном атоме углерода, а во втором — при вторичном. Одинаковы ли скорости этих реакций? Оказывается, что в конечной смеси преобладает продукт замещения атома водорода, который находится при вторичном углероде, т. е. 2-бромпропан (СН3—СНВг—СН3). Давайте попытаемся объяснить это.Для того чтобы это сделать, нам придется воспользоваться представлением об устойчивости промежуточных частиц. Вы обратили внимание, что при описании механизма реакции хлорирования метана мы упомянули радикал метил — СН3·? Этот радикал является промежуточной частицей между метаном СН4 и хлорметаном СН3Сl. Промежуточной частицей между пропаном и 1-бромпропаном является радикал с неспаренным электроном при первичном углероде, а между пропаном и 2-бромпропаном — при вторичном.
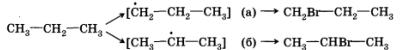
Радикал с неспаренным электроном при вторичном атоме углерода (б) является более устойчивым по сравнению со свободным радикалом с неспаренным электроном при первичном атоме углерода (а). Он и образуется в большем количестве. По этой причине основным продуктом реакции бромирования пропана является 2-бром-пропан — соединение, образование которого протекает через более устойчивую промежуточную частицу.
Приведем несколько примеров свободнорадикальных реакций:
Реакция нитрования (реакция Коновалова)
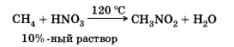
Реакция применяется для получения нитросоединений — растворителей, исходных веществ для многих синтезов.
Каталитическое окисление алканов кислородом
Эти реакции являются основой важнейших промышленных процессов получения альдегидов, кетонов, спиртов непосредственно из предельных углеводородов, например:
СН4 + [О] —> СН3ОН
Применение
Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.
Соединения, полученные из метана, самого дешевого углеводородного сырья, применяют для получения множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений.
Углеводороды более высококипящих фракций нефти используются как горючее для дизельных, турбореактивных двигателей, как основа смазочных масел, как сырье для производства синтетических жиров и т. д.
Приведем несколько промышленно значимых реакций, протекающих с участием метана. Метан используют для получения хлороформа, нитрометана, кислородсодержащих производных. Спирты, альдегиды, карбоновые кислоты могут образовываться при непосредственном взаимодействии алканов с кислородом в зависимости от условий проведения реакций (катализатора, температуры, давления):

Как вы уже знаете, углеводороды состава от С5Н12 до С11Н24 входят в бензиновую фракцию нефти и применяются в основном как горючее для двигателей внутреннего сгорания. Известно, что наиболее ценными компонентами бензина являются изомерные углеводороды, так как они обладают максимальной детонационной устойчивостью.
Углеводороды при контакте с кислородом воздуха медленно образуют с ним соединения — перекиси. Это медленно протекающая свободнорадикальная реакция, инициатором которой является молекула кислорода:
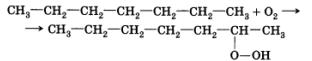
Обратите внимание на то, что гидропероксидная группа образуется при вторичных атомах углерода, которых больше всего в линейных, или нормальных, углеводородах.
При резком повышении давления и температуры, происходящем в конце такта сжатия, начинается разложение этих перекисных соединений с образованием большого числа свободных радикалов, которые «запускают» свободнорадикальную цепную реакцию горения раньше, чем это необходимо. Поршень еще идет вверх, а продукты горения бензина, которые уже успели образоваться в результате преждевременного поджига смеси, толкают его вниз. Это приводит к резкому уменьшению мощности двигателя, его износу.Таким образом, основной причиной детонации является наличие перекисных соединений, способность образовывать которые максимальна у линейных углеводородов.Наименьшей детонационной устойчивостью среди углеводородов бензиновой фракции (С5Н14 — С11Н24) обладает к-гептан. Наиболее устойчив (т. е. в наименьшей степени образует перекиси) так называемый изооктан (2,2,4-триметилпентан).
Общепринятой характеристикой детонационной устойчивости бензина является октановое число. Октановое число 92 (например, бензин А-92) означает, что данный бензин обладает теми же свойствами, что и смесь, состоящая из 92% изооктана и 8% гептана.
В заключение можно добавить, что использование высокооктанового бензина дает возможность повысить степень сжатия (давление в конце такта сжатия), что приводит к повышению мощности и КПД двигателя внутреннего сгорания.
17. Спирты
Строение
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
• одноатомные
• двухатомные (гликоли)
• трехатомные.
По характеру углеводородного радикала выделяют следующие спирты:
• предельные, содержащие в молекуле лишь предельные углеводородные радикалы
• непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода
• ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода.
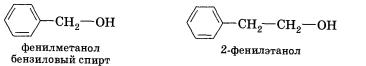
Органические вещества, содержащие в молекуле гидрок-сильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например, гидроксибензол фенол. Подробнее со строением, свойствами и применением фенолов мы познакомимся позже.
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует заметить, что спирты, содержащие две гидроксильные группы при одном атоме углерода, неустойчивы и самопроизвольно разлагаются (подвергаются перегруппировке атомов) с образованием альдегидов и кетонов:
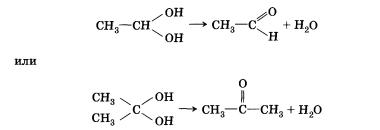
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид.
По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на:
• первичные, в молекулах которых гидроксильная группа связана с первичным атомомуглерода
• вторичные, в молекулах которых гидроксильная группа связана с вторичным атомом углерода
• третичные, в молекулах которых гидроксильная группа связана с третичным атомом углерода, например:
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
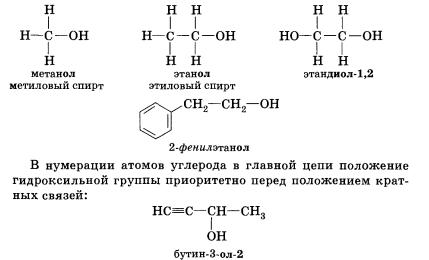
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерияуглеродного скелета (бутанол-1; 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам.
рода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. Благодаря этому в молекулах спиртов имеются полярные связи С—О и О—Н.
Физические свойства спиртов
Учитывая полярность связи О—Н и значительный частичный положительный заряд, локализованный (сосредоточенный) на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал.
Необходимо отметить, что атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность спиртам образовывать особые, так называемые водородные связи между молекулами. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу 32, в обычных условиях жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и ок-танол уже не смешивается с водой.
Химические свойства
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельнымиметаллами (замещаться на них).
С водой это взаимодействие идет значительно активнее, чем со спиртом, сопровождается большим выделением тепла, может приводить к взрыву. Это различие объясняется электронодонорными свойствами ближайшего к гидроксильной группе радикала. Обладая свойствами донора электронов (+I-эффектом), радикал несколько повышает электронную плотность на атоме кислорода, «насыщает» его за свой счет, уменьшая тем самым полярность О—Н-связи и «кислотный» характер атома водорода гидроксильной группы в молекулах спиртов по сравнению с молекулами воды.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов.
Например:
С2Н5ОН + НВг <-> С2Н5Вг + Н2O
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 °С образуется диэтиловый (серный) эфир.
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
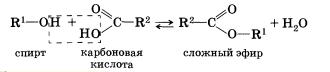
Реакция этерификации катализируется сильными неорганическими кислотами.Например, при взаимодействии этилового спирта и уксус-аой кислоты образуется уксусноэтиловый эфир — этилацетат:
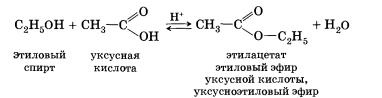
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате ее образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксиль-ной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140 °С в присутствии концентрированной серной кислоты.
6. Окисление спиртов обычно проводят сильными окислителями, например дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
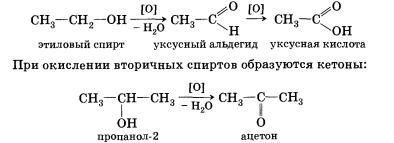
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов. При пропускании паров спирта при 200—300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
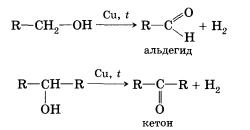
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди(II).Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Алкоголяты щелочных и щелочноземельных металлов подвергаются гидролизу при взаимодействии с водой. Например, при растворении этилата натрия в воде протекает обратимая реакция
С2Н5ОNа + НОН <-> С2Н5ОН + NаОН
равновесие которой практически полностью смещено вправо. Это также подтверждает, что вода по своим кислотным свойствам («кислотному» характеру водорода в гидроксильной группе) превосходит спирты. Таким образом, взаимодействие алкоголятов с водой можно рассматривать как взаимодействие соли очень слабой кислоты (в данном случае в этом качестве выступает спирт, образовавший алкоголят) с кислотой более сильной (эту роль здесь играет вода).
Спирты могут проявлять основные свойства при взаимодействии с сильными кислотами, образуя соли алкилоксония благодаря наличию неподеленной электронной пары на атоме кислорода гидроксильной группы:
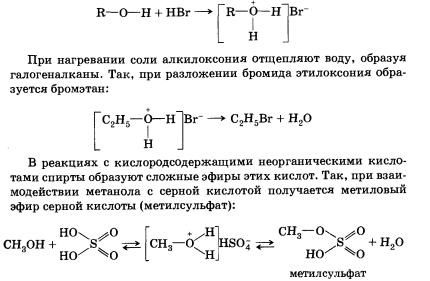
Реакция этерификации обратима (обратная реакция — гидролиз сложного эфира), равновесие смещается вправо в присутствии водоотнимающих средств.Внутримолекулярная дегидратация спиртов протекает в соответствии с правилом Зайцева: при отщеплении воды от вторичного или третичного спирта атом водорода отрывается от наименее гидрированного атома углерода. Так, дегидратация бутанола-2 приводит к бутену-2, а не бутену-1.
Наличие в молекулах спиртов углеводородных радикалов не может не сказаться на химических свойствах спиртов.
Химические свойства спиртов, обусловленные углеводородным радикалом, различны и зависят от его характера. Так, все спирты горят; непредельные спирты, содержащие в молекуле двойную С=С связь, вступают в реакции присоединения, подвергаются гидрированию, присоединяют водород, реагируют с галогенами, например, обесцвечивают бромную воду, и т. д.
Способы получения
1. Гидролиз галогеналканов. Вы уже знаете, что образование галогеналканов при взаимодействии спиртов с галогено-водородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой.
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле.
2. Гидратация алкенов — присоединение воды по тг-связи молекулы алкена — уже знакома вам. Гидратация пропена приводит в соответствии с правилом Марковникова к образованию вторичного спирта — пропанола-2
ОН
l
СН2=СН—СН3 + Н20 -> СН3—СН—СН3
пропен пропанол-2
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов.
4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена).
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода(II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка).
Необходимую для этой реакции смесь угарного газа и водорода, называемую также (подумайте почему!) «синтез-газ», получают при пропускании паров воды над раскаленным углем.
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен.
Рассмотрим реакцию получения спиртов из галогеналканов — реакцию гидролиза галогенпроизводных углеводородов. Ее обычно проводят в щелочной среде. Выделяющаяся бромоводородная кислота нейтрализуется, и реакция протекает практически до конца.Эта реакция, как и многие другие, протекает по механизму нуклеофильного замещения.Это реакции, основной стадией которых является замещение, протекающее под воздействием нуклеофильной частицы.Напомним, что нуклеофильной частицей является молекула или ион, имеющая неподеленную электронную пару и способная притягиваться к «положительному заряду» — участкам молекулы с пониженной электронной плотностью.
Наиболее распространенными нуклеофильными частицами являются молекулы аммиака, воды, спирта или анионы (гидроксил, галогенид, алкоксид-ион).Частицу (атом или группу атомов), замещаемую в результате реакции на нуклеофил, называют уходящей группой.
Замещение гидроксильной группы спирта на галогенид-ион также протекает по механизму нуклеофильного замещения:
СН3СН2ОН + НВг —> СН3СН2Вг + Н20
Интересно, что эта реакция начинается с присоединения катиона водорода к атому кислорода, содержащегося в гидроксильной группе:
СН3СН2—ОН + Н+ —> СН3СН2— ОН
Под действием присоединившегося положительно заряженного иона связь С—О еще больше смещается в сторону кислорода, эффективный положительный заряд на атоме углерода увеличивается.
Это приводит к тому, что нуклеофильное замещение на галогенид-ион происходит гораздо легче, а отщепляется под действием нуклеофила молекула воды.
СН3СН2—ОН+ + Вг —> СН3СН2Вг + Н2O
Получение простых эфиров
При действии алкоголята натрия на бромэтан происходит замещение атома брома на алкоголят-ион и образуется простой эфир.
Реакцию нуклеофильного замещения в общем виде можно записать следующим образом:
R - X +HNu -> R - Nu +HX,
если нуклеофильной частицей является молекула (НВг, Н20, СН3СН2ОН, NН3, СН3СН2NН2), или
R—X + Nu- —> R—Nu + Х-,
если нуклеофилом является анион (ОН , Вг-, СН3СН2O-), где X — галоген, Nu — нуклеофильная частица.
Отдельные представители спиртов и их значение
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт — объясняется одним из способов его получения — перегонкой твердых пород дерева (греч. — вино, опьянеть; вещество, древесина).
Метанол очень ядовит! Он требует осторожного обращения при работе с ним. Под действием фермента алкогольде-гидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96% (по объему) этанола и 4% (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди(II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным или денатуратом.
Этанолшироко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах, значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пропантриол-1,2,3 (глицерин) — вязкая, сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел. Широко используется в косметике, фармацевтической ипищевой промышленности. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание. К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и таким образом придавая пластмассам необходимую гибкость и эластичность.
Дата добавления: 2015-01-10; просмотров: 2606;
