Окислительно-восстановительные реакции. Многообразие классификаций химических реакций по различным признакам (фазе, направлению, числу и характеру реагирующих и образующих веществ
Многообразие классификаций химических реакций по различным признакам (фазе, направлению, числу и характеру реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
Например, в реакции
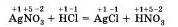
степени окисления атомов химических элементов после реакции не изменились. А вот в другой реакции — взаимодействие соляной кислоты с цинком
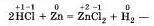
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону:
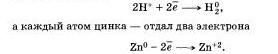
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Под восстановлением понимают процесс присоединения электронов атомами, ионами илимолекулами. Степень окисления ири этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, то есть восстанавливаясь:
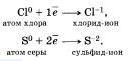
Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:
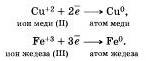
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается.
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами. Например, атомы металлов, теряя электроны, превращаются в положительные ионы, то есть окисляются:
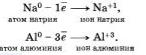
Отдавать свои электроны могут отрицательные ионы.
Терять электроны могут и некоторые положительные ионыс низшими степенями окисления.
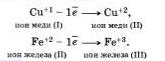
Можно отметить, что при этом степень окисления повышается.
Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, то есть окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления н восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, то есть соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.

Молекулярное уравнение этой реакции написать уже несложно, так как коэффициенты для него будут взяты из электронных уравнений.
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Как вы помните, первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространялось на серную кислоту концентрированную и азотную кислоту любой концентрации.
В отличие от соляной кислоты, в которой окислителем атомов металла были катионы водорода, в серной и азотной кислотах окислителями являются атомы серы и азота из сульфат-ионов и нитрат-ионов. Поэтому H2S04 (конц.) и HNO3, (любой конц.) взаимодействуют с металлами, стоящими в ряду напряжений как до водорода, так и после него, восстанавливаясь при атом до S02, NO и т. д. Например, при взаимодействии разбавленной азотной кислоты с медью получается нитрат меди (II), оксид азота (II) и вода. Запишем формулы исходных и конечных веществ с указанием степеней окисления:
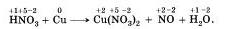
Подчеркнем знаки химических элементов, изменивших свои степени окисления.
Составим электронные уравнения, то есть отразим процессы отдачи и присоединения электронов:

Ставим коэфициент 3 перед Cu и перед формулой нитрата меди, в котором Cu +2, так как с такими значениями степеней окисления медь встречается по одному разу.

Проверим правильность расстановки коэффициентов, подсчитав число атомов кислорода до и после реакции: до реакции — 24 атома и после реакции — 24 атома. Коэффициенты расставлены правильно, поэтому заменим в уравнении стрелку на знак равенства:
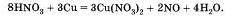
Зная формулу вещества и определив степени окисления атомов химических элементов в нем. нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом: окислительные или восстановительные. Например, азот в азотной кислоте имеет максимальное значение степени окисления +5, то есть он "потерял" все электроны, поэтому азот и азотная кислота будут проявлять только окислительные свойства.
Азот в аммиаке NH3, имеет минимальное значение степени окисления -3. то есть он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
Другой пример — оксид азота (II) N0. Азот в этом соединении имеет промежуточное значение степени окисления и поэтому может проявлять как окислительные, так и восстановительные свойства.
Приведем примеры важнейших восстановителей и окислителей.

Дата добавления: 2015-01-10; просмотров: 1370;
