Поведение комплексных соединений в растворах.
Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей (метод валентных связей), теория кристаллического поля и метод молекулярных орбиталей.
В рамках метода валентных связей считается, что между комплексообразователем и лигандами существует чисто ковалентная связь, которая реализуется по донорно-акцепторному механизму.
Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
1. Связь между комплексообразователем и лигандами донорно-акцепторная σ-типа. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали.
2. Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов.
3. Дополнительное упрочение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда.
4. Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
Теория кристаллического поля — квантохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояния иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Гансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами - как анионами, так и нейтральными молекулами. Теория кристаллического поля была в дальнейшем объединена с теорией молекулярных орбиталей в более общую теорию поля лигандов, учитывающую частичную ковалентность связи металл-лиганд в координационных соединениях. Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонанса кристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов. Согласно ТКП, взаимодействие между переходным металлом и лигандами возникает вследствие притяжения между положительно заряженным катионом металла и отрицательным зарядом на несвязывающих электронах лиганда. Теория рассматривает изменение энергии пяти вырожденных d-орбиталей в окружении точечных зарядов лигандов. По мере приближения лиганда к иону металла, электроны лиганда становятся ближе к некоторым d-орбиталям, чем к другим, вызывая потерю вырожденности. Электроны d-орбиталей и лигандов отталкиваются друг от друга как заряды с одинаковым знаком. Таким образом, энергия тех d-электронов, которые ближе к лигандам, становится выше, чем тех, которые дальше, что приводит к расщеплению уровней энергии d-орбиталей.
На расщепление влияют следующие факторы:
· Природа иона металла.
· Степень окисления металла. Чем выше степень окисления, тем выше энергия расщепления.
· Расположение лигандов вокруг иона металла.
· Природа лигандов, окружающих ион металла. Чем сильнее эффект от лигандов, тем больше разность между высоким и низким уровнем энергии.
8. Генетическая связь солей, оснований, кислот
Генетическойназывается связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ.
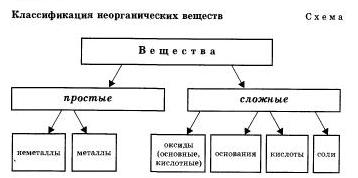
Вначале наши сведения о классификации веществ представим в виде схемы.
Зная классы простых веществ, можно составить два генетических ряда: генетический ряд металлов и генетический ряд неметаллов.
Генетический ряд металлов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же металл.
Различают две разновидности генетического ряда металлов
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. В общем виде такой ряд может быть представлен следующей цепочкой превращений:

2. Генетический ряд металлов, которым соответствует нерастворимое основание. Этот ряд богаче генетическими связями, так как полнее отражает идею взаимных превращений (прямых и обратных). В общем виде такой ряд может быть представлен следующей цепочкой превращений:
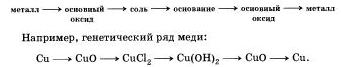
Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же неметалл.
Здесь также можно выделить две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть отражен в виде такой цепочки превращений:
неметалл -> кислотный оксид -> кислота -> соль
Например, генетический ряд фосфора:
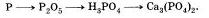
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть иредставлен с помощью такой цепочки превращений:
неметалл —► кислотный оксид —► соль —► кислота —► кислотный оксид —►неметалл
Так как из изученных нами кислот нерастворимой является только кремниевая кислота, в качестве примера последнего генетического ряда рассмотрим генетический ряд кремния:

9. Свойства серной кислоты
Дата добавления: 2015-01-10; просмотров: 1974;
