Некоторых металлов ( ряд напряжений ) при 298К.
| Электродная полуреакция |
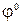 , В , В
| Электродная полуреакция |
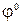 , В , В
|
| Li+ (водн.) + 1e- = Li (тв.) | -3.045 | Cd2+ (водн.) + 2e- = Cd (тв.) | -0.403 |
Rb+ (водн.) + 1e- =Rb(тв.) 
| -2.925 | Co2+ (водн.) + 2e- = Co (тв.) | -0.277 |
| K+ (водн.) + 1e- = K (тв.) | -2.924 | Ni2+ (водн.) + 2e- = Ni (тв.) | -0.250 |
| Cs+ (водн.) + 1e- = Cs (тв.) | -2.923 | Sn2+ (водн.) + 2e- = Sn (тв.) | -0.136 |
| Ba2+ (водн.) + 2e- = Ba (тв.) | -2.905 | Pb2+ (водн.) + 2e- = Pb (тв.) | -0.126 |
| Ca2+ (водн.) + 2e- = Ca (тв.) | -2.866 | Fe3+ (водн.) + 3e- = Fe (тв.) | -0.037 |
| Na+ (водн.) + e- = Na (тв.) | -2.714 | 2H+ (водн.) + 2e- = H2 (г.) | 0.000 |
| Mg2+ (водн.) + 2e- = Mg (тв.) | -2.363 | Sb3+ (водн.) + 3e- = Sb (тв.) | +0.200 |
| Al3+ (водн.) + 3e- = Al (тв.) | -1.663 | Bi3+ (водн.) + 3e- = Bi (тв.) | +0.215 |
| Ti2+ (водн.) + 2e- = Ti (тв.) | -1.630 | Cu2+ (водн.) + 2e- = Сu (тв.) | +0.337 |
| Zr4+ (водн.) + 4e- = Zr (тв.) | -1.539 | Cu+ (водн.) + e- = Cu (тв.) | +0.520 |
| Mn2+ (водн.) + 2e- = Mn (тв.) | -1.179 | Ag+ (водн.) + e- = Ag (тв.) | +0.799 |
| V2+ (водн.) + 2e- = V (тв.) | -1.175 | Hg2+ (водн.) + 2e- = Hg (ж.) | +0.850 |
| Cr2+ (водн.) + 2e- = Cr (тв.) | -0.913 | Pd2+ (водн.) + 2e- = Pd (тв.) | +0,987 |
| Zn2+ (водн.) + 2e- = Zn (тв.) | -0.763 | Pt2+ (водн.) + 2e- = Pt (тв.) | +1,188 |
| Cr3+ (водн.) + 3e- = Cr (тв.) | -0.744 | Au3+ (водн.) + 3e- = Au (тв.) | +1,498 |
| Fe2+ (водн.) + 2e- = Fe (тв.) | -0.440 | Au+ (водн.) + e- = Au (тв.) | +1,692 |
Электродные потенциалы со знаком «минус» относятся к тем металлам, которые вытесняют водород из кислот. В заголовке таблицы – «Стандартные электродные потенциалы» соответствуют потенциалам, определенных в стандартных условиях: температура t =250C (Т = 298 К), давление Р = 1 атм, концентрация раствора, в который погружен электрод С = 1 моль/л. φ0 --- ст. усл.
 Чем меньше электродный потенциал φ, тем активнее металл, тем большим восстановителем он является.
Чем меньше электродный потенциал φ, тем активнее металл, тем большим восстановителем он является.
Пример. Какой металл более активный цинк или алюминий? Ответ: Алюминий, так как его потенциал (по таблице №3) меньше, чем у цинка.
Дата добавления: 2015-01-21; просмотров: 1066;
