Сильные электролиты.
| Сильные кислоты | Сильные основания |
| HCl ↔ Н+ + Cl− | NaOH↔Na+ + ОН− |
| H2SO4 ↔ 2 Н+ + SO42− | KOH↔ K+ + ОН− |
| HNO3 ↔ Н+ + NO3− |
Если в таблице частицы нет, то это будет слабая частица(слабый ион).
Соль состоит из катиона (положительный ион) и аниона (отрицательный ион):
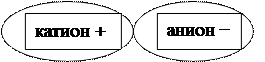
Ме+n К.О.-n (кислотный остаток)
Возможны 4 комбинации соли: 1. сильный + и сильный −
2. сильный + и слабый −
3. слабый + и сильный −
4.слабый + и слабый −
Рассмотрим реакции с такими вариациями ионов:
1.NaCl + H2O гидролиза нет, так как нет слабой частицы в соли, и не меняется рН (равен 7)
 |
силь+силь
реакция нейтральная, и идет диссоциацияна ионы: NaCl + H2O ↔ Na++ Cl−+ H2O
2. гидролиз соды (технической)
 Na2CO3 + H2O ↔
Na2CO3 + H2O ↔
сильн+слаб






 CO32−+ Н+ОН- ↔ Н+CO32− − + ОН- среда щелочная, рН>7 , нужно далее написать в молекулярном виде
CO32−+ Н+ОН- ↔ Н+CO32− − + ОН- среда щелочная, рН>7 , нужно далее написать в молекулярном виде
 |  | ||

 Na2CO3 + H2O ↔ Na+ Н+CO32− О + Na+ОН- О
Na2CO3 + H2O ↔ Na+ Н+CO32− О + Na+ОН- О
3. Гидролиз сульфата цинка

 ZnSO4 + H2O ↔
ZnSO4 + H2O ↔
слаб+сильн




 Zn+2 + Н+ОН- ↔ Zn+2ОН- + + Н+ среда кислая, рН<7, нужно далее написать в молекулярном виде
Zn+2 + Н+ОН- ↔ Zn+2ОН- + + Н+ среда кислая, рН<7, нужно далее написать в молекулярном виде
 | |||
 |
2ZnSO4 +2H2O ↔ ( Zn+2ОН- )+2 SO42- О + Н2+ SO42- О
 |  |
4. гидролиз карбоната алюминия идет до конца, так как соль составлены из двух слабых частиц.
Al2(СO3)3 + 6H2O ↔ 2Al(OH)3 + 3H2CO3
Дата добавления: 2015-01-21; просмотров: 967;
