БИОСИНТЕЗ
Инсулин синтезируется b-клетками островков Лангерганса в виде одноцепочечного предшественника — проинсулина с молекулярной массой около 9000 [28]. Современные исследования на бесклеточных системахпоказывают, что ближайшим продуктом трансляции проинсулиновой мРНК является более крупный пептид с молекулярной массой 11 500, содержащий 23 дополнительных аминокислотных остатка на аминоконце молекулы. Этот предшественник получил название препроинсулина, и считают, что он быстро (в течение нескольких минут после синтеза) расщепляется микросомными протеазами до проинсулина. Дополнительный пептид в препроинсулине по своему размеру, содержанию отдельных аминокислот и положению на аминоконце сходен с дополнительными последовательностями, найденными в продуктах трансляции in vitro мРНК различных гормонов, таких, как пропаратиреоидный гормон и гормон роста, равно, как и негормональных белков, таких, как легкие цепи иммуноглобулинов [29].
Проинсулин представляет собой спиральную молекулу, в которой А- и В-цепи составляют единую последовательность за счет соединяющего пептида (С-пептида), состоящего из 26—31 аминокислотного остатка (рис. 10—11). Если аминокислотные последовательности А- и В-цепей у разных видов имеют небольшие различия, то строение соответствующих С-пептидов разнится го-
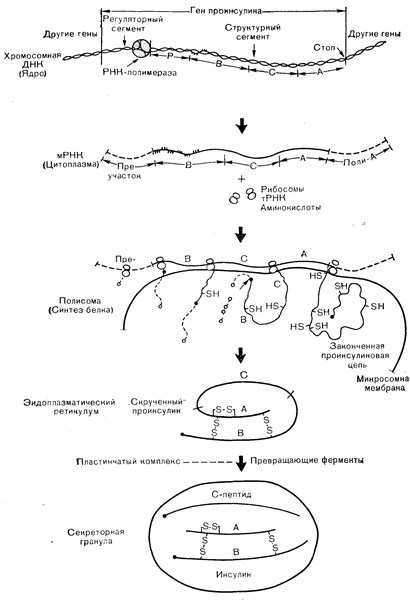
Рис. 10—11. Схематическое изображение биосинтеза проинсулина, его превращения в инсулин и С-пептид. Ген проинсулина представлен в верхней части рисунка. Эти гены содержат интроны, продукты которых исключаются из состава зрелой мРНК. Транскрипция препроинсулиновой мРНК требует присутствия фермента РНК-полимеразы. Эта мРНК служит матрицей для образования цепей препроинсулина на полирибосомах. Препроинсулин расщепляется до проинсулина (средняя часть рисунка), который затем переносится в аппарат Гольджи (пластинчатый комплекс), где и происходит его превращение в инсулин (по Steiner D. F., Diabetes, 1977,26,322). раздо больше. Так, инсулин свиньи отличается от инсулина человека только одной аминокислотой, тогда как С-пептид человека — цепь из 23 аминокислотных остатков с молекулярной массой 3021 — отличается от свиного С-пептида 10 остатками и содержит на 2 аминокислоты меньше [30]. Столь высокая «мутабельность» согласуется с отсутствием у С-пептида специфической гормональной функции. Хотя проинсулин обнаруживает небольшую перекрестную реакцию с антителами к инсулину, он обладает всего" 3—5% от биологической эффективности нативного инсулина, Не ясно, принадлежит ли эта небольшая биологическая, активность непосредственно проинсулину, или она обусловлена его превращением тканями-мишенями в инсулин.
Синтез препроинсулина в клетке и его быстрое? расщепление-до проинсулина происходит на полисомах шероховатого эндоплазматического ретикулума. Затем в ходе энергозависимого процесса проинсулин переносится в пластинчатый комплекс (аппарат Гольджи), где происходит его упаковка в микропузырьки с гладкой поверхностью, в форме которых и осуществляется хранение и секреция (см. рис. 10—11). С момента попадания в пластинчатый комплекс и в секреторных гранулах мембранные протеазы расщепляют проинсулин на эквимолярные количества инсулина и С-пептида. Инсулин вместе с цинком накапливается в центральной области созревающей секреторной гранулы, приобретающей все большую электронную плотность; С-пептид локализуется в периферическом прозрачном пространстве секреторной гранулы.
Высвобождение содержимого зрелых секреторных гранул происходит путем постепенного их продвижения к плазматической мембране клетки, вслед за чем инсулин и С-пептид выталкиваются наружу. Движение гранул к плазматической мембране в цитозоле b-клеток направляется микротрубочками — структурами, имеющими диаметр 24 нм и состоящими из димерных субъединиц белка с молекулярной массой 120 000, известного под названием тубулин. Вблизи плазматической мембраны, окружая секреторные гранулы, располагается сеть микронитей — структур с диаметром 4—8 нм и состоящих, как полагают, из сократительного| белка актина. Принято считать, что на конечном общем этапа секреции b-клеток начинается поступление кальция внутрь клетки, что приводит к сокращению микронитей [31]. В результате секреторные гранулы приближаются к поверхности клеток, где их мембраны сливаются с плазматической мембраной, а их содержимое выбрасывается во внеклеточное пространство. Этот процесс слияния мембран называется эмиоцитозом или экзоцитозом.
Недавняя разработка методов химического синтеза ДНК в сочетании с использованием рекомбинаций ДНК обусловила возможность получения крысиного проинсулина или отдельных А- и В-цепей инсулина человека с помощью бактериальных клеток (Escherichia coli) [26, 32]. План синтеза предполагает либо обратную транскрипцию проинсулиновой мРНК с тем, чтобы полу-
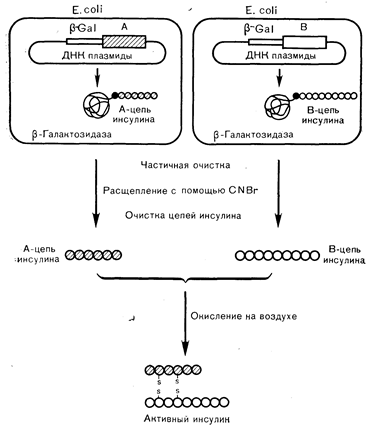
Рис. 10—12. Схематическое изображение синтеза А- и В-цепей инсулина бактерий (Е. coli) с помощью методики рекомбинации ДНК (по Riggs A., Itakura К., Am. J. Hum. Genet, 1979, 31, 351). чить кДНК (ДНК-«копию») для проинсулина, либо химический синтез меньших фрагментов ДНК, кодирующих А- и В-цепи инсулина человека. Синтетические гены затем объединяются с геном, в норме экспрессированном в клетке Е. coli (например, геном пенициллиназы или b-галактозидазы), что обеспечивает эффективную транскрипцию и трансляцию, т. е. образование стабильного белка-предшественника, или (в случае периплазматического белка, такого, как пенициллиназа) способствует транспорту продукта из клетки. Векторами, применяющимися для внесения чужеродной и бактериальной ДНК в бактериальную клетку, служат либо бактериофаги, либо плазмиды. Бактерия, содержащая плазмиду, транскрибирует свой собственный ген, равно, как и внедренную последовательность, продуцируя тем самым нужный полипептид (рис, 10—12). Тот факт, что последователь- ность эукариотической ДНК удается клонировать и экспрессировать в прокариотических (бактериальных) клетках, может найти наиболее быстрое применение в области использования бактериального синтеза для продукции инсулина человека, нужного для лечения больных с инсулинозависимым диабетом. Такая технология тем самым может обеспечить создание альтернативного источника инсулина и в конце концов вытеснить современные способы получения гормона, заключающиеся в экстракции свиных и бычьих поджелудочных желез.
Дата добавления: 2015-01-19; просмотров: 1707;
