Биосинтез
Исследования биосинтеза АКТГ в интактном гипофизе крупного рогатого скота и в клетках опухоли гипофиза мыши показали, что этот гормон образуется как часть крупной молекулы предшественника с молекулярной массой около 29000 [13] (рис. 7—4). Это вещество содержит углеводный компонент [14], и небольшие колебания его молекулярной массы, наблюдаемые некоторыми исследователями, обусловлены, вероятно, различиями в содержании углевода, а не аминокислот. Присутствие углевода в молекуле предшественника АКТГ помогает понять базофильное окрашивание АКТГ-секретирующих клеток. Предшественник постепенно расщепляется, образуя молекулы в 21 000 и 4500 дальтон, причем последняя представляет собой 39-аминокпслотный мономер. Недавно проведенные на бесклеточных белоксинтезирующих системах исследования показали, что соединение с молекулярной массой 29 000 дальтон служит предшественником и 91-аминокислотного b-ЛПГ. Таким образом, данные об идентификации АКТГ и МСГ н даже b-ЛПГ в одной и той же клетке с помощью нммуноцитохимических методик с антителами к неперекрывающимся частям молекулы могут объясняться присутствием общего предшественника. Пока не выявлены специфические ферменты (эндопептидазы), ответственные за расщепление предшественника, вопрос о том, действительно ли все молекулы меньших размеров (т. е. рассматриваемые далее АКТГ, b-ЛПГ, а также эндорфины и энкефалины) присутствуют в отдельной клетке в качестве обособленных форм, может быть решен лишь гипотетически. Очевидно также, что общпй гептапептид (АКТГ4-ю) должен располагаться по крайней мере в двух разных участках молекулы предшественника, поскольку последовательности АКТГ и b-ЛПГ не перекрываются.
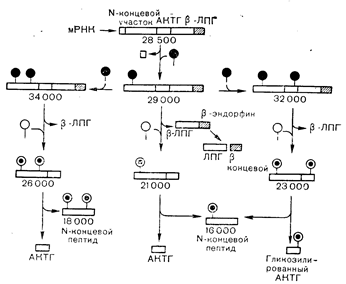
Рис. 7—4. Путь биосинтеза гормонов, родственных АКТГ и b-ЛПГ. Единая иРНК направляет трансляцию полипептида-предшественника, содержащего аминокислотную последовательность N-концевого фрагмента (предположительно являющегося гормоном, но функция которого пока не установлена), АКТГ, a-, b- и g-меланоцитстимулирующего гормона (g-МСГ), кортикотропинподобного пептида промежуточной доли КПППД (АКТГ18-38), b-ЛПГ, метэнкефалина и b-эндорфина. По мере синтеза этого белка-предшественника он гликозилируется (показано черными кружками). Последовательность «сигнального пептида», необходимая для трансляции и проникновения белка-предшественника в эндоплазматический ретикулум, отщепляется. Таким образом, наиболее рано определяемая в клетке форма молекулы имеет молекулярную массу около 29000 и содержит углевод в указанных положениях. Эта молекула затем подвергается дополнительным процессам гликозилирования, которое может происходить либо на N-концевом фрагменте (левая часть рисунка), либо на ее участке, содержащем последовательность АКТГ (правая часть рисунка), образуя формы с молекулярной массой 34000 и 32000. Белые кружки обозначают последующую модификацию углеводной боковой цепи. Первый протеолитический этап включает отщепление b-ЛПГ от С-концевого участка предшественника; b-ЛПГ может затем превращаться в b-эндорфин. Хотя b-эндорфин содержит аминокислотную последовательность и мет-энкефалина, продукция этого пептида в гипофизе не показана. Протеолиз фрагментов, остающихся после отщепления b-ЛПГ, приводит к отщеплению N-концевого участка, молекулярная масса которого зависит от содержания в нем сахара, и к образованию АКТГ, который также присутствует в гликозилированной (13000 дальтон) и негликозилированной (4500 дальтон) формах [Herbert Е. и соавт. — In. Martini L., Ganong F. (eds), Frontiers in Neuroendocrinology.—New York, Raven Press (в печати)].
Дата добавления: 2015-01-19; просмотров: 1474;
