Механизмы биоорганических реакций
Под механизмом реакции подразумевается подробное описание процесса, в результате которого реагенты превращаются в продукты.
Изучение механизма реакции включает в себя исследование( или умозрительное предположение) :
- этапов реакции
- электронного и пространственного строения промежуточных частиц, которые образуются во время реакции.
Механизм реакции должен быть подтвержден экспериментально с использованием нескольких соединений гомологического ряда или веществ, отличающихся только заместителями. В процессе познания представления о механизме реакции могут изменяться или даже полностью отвергаться. Для некоторых реакций на данном этапе развития науки, может быть предложено несколько механизмов, каждый из которых имеет свои подтверждения .
Если механизм реакции изучен и подтвержден , то делают дополнение к типу реакции,
указывая электронную природу активных промежуточных частиц, определяющих механизм реакции:
А Е - реакция электрофильного присоединения
А Nu - реакция нуклеофильного присоединения.
S Е - реакция электрофильного замещения
S R -реакция радикального замещения
Реакционная способность- тип реакции и электронная природа промежуточных активных частиц- зависит от строения биоорганического соединения, типа связей.
Например, для непредельных соединений характерны реакции А Е , для ароматических соединений - S Е , спиртов - S N .
4.2.1. Реакции электрофильного присоединения в ряду алкенов(А Е)
Характерны для алкенов, содержащих изолированные и сопряженные двойные связи.
В реакциях могут участвовать галогены , галогеноводороды, спирты, карбоновые кислоты, вода. Присоединение воды-гидратация- наиболее важный вид реакций in vivo.
Вспомним реакции , которые изучают в школьной программе органической химии:
А) Присоединение галогенов- дигалогенирование. Обычно используют раствор галогена в СС14 . Обесцвечивание раствора бромной воды- качественная реакция на двойную связь.
> CH=CH< + Вг2 —> > CH Вг — СHВг< дибромалкан
Б) Присоединение галогеноводорода- гидрогалогенирование
> CH=CH< +НВг —> > CH2 — СHВг< бромалкан
В) Присоединение воды. В отличие от предыдущих реакций происходит в условиях кислотного катализа, чаще используют серную кислоту
Н2 S О4
> CH=CH< +НОН ——> > CH2 — СH<
|
ОН алканол(спирт)
Если двойная связь несимметричная, то для оценки направления реакции используют эмпирическое ( опытное) правило Марковникова (empeiria- греч- опыт ) : атом водорода присоединяется к более ”гидрированному“ атому углерода, если рядом с двойной связью расположен заместитель-донор.
СН2 = СН— СН3 + НС1 ——> СН3 — СН — СН2Н
пропен | 2-хлорпропан
С1
Реакция идет против правила Марковникова, если рядом с двойной связью располагается заместитель- акцептор.
СН2 = СН— СООН + НС1 ——> СН2 — СН — СООН
пропеновая кислота | | 3-хлорпропановая кислота
С1 Н
Для объяснения правила Марковникова можно использовать два объяснения, используя знание о распределении электронной плотности в молекуле :
1. статическое - изначальное распределение
2. динамическое - возникающее в процессе реакции, которое связано с конкретным механизмом реакции.
В молекулах пропена и пропеновой ( акриловой) кислоты различное распределение электронной плотности , в соответствии с этим распределением происходит присоединение заряженных частиц ( Н+ и С1– )
б – б+
СН2 = СН <— СН3 СН2 = СН —> СООН
донор ( +I ) акцептор ( -I )
Механизм реакции А Е
Реакционный процесс можно представить в виде нескольких стадий:
1. атака электрофилом двойной связи
2. образование π -комплекса
3. превращение π -комплекса в σ- комплекс( карбокатион). Из двух возможных
карбокатионов образуется более устойчивый
4. присоединение нуклеофила, образование конечного продукта реакции
Положительно заряженная частица электрофил( чаще всего Н+) ориентируется около электронов двойной связи, которые располагаются перпендикулярно σ- скелету. В поле притяжения электрофила находится отрицательно заряженный нуклеофил( в нашем конкретном случае Вг – ). Затем протон образует химическую σ- связь с одним из двух атомов углерода. Для образования связи нужна пара электронов. Поэтому соседний атом теряет свой электрон и приобретает заряд (+), получается карбокатион. Всегда возможно образование двух карбокатионов. Далее в реакции присоединения нуклеофильной частицы участвует тот карбокатион, который более устойчив. Нуклеофильная частица присоединяется с противоположной стороны по отношению к протону.
На схеме представлены два возможных пути присоединения протона Н+ после образования π –комплекса ( карбокатионы I и II ).
Более устойчивым является карбокатион I, поскольку заряд (+ ) который соответствует свободной электронной орбитали - компенсируется донорным действием двух соседних радикалов( метильных групп), а в карбокатионе II – только со стороны одного радикала ( этильной группы).
При исследовании реакции присоединения бромоводорода к пропену установлено , что полностью образуется 2-бромпропан, и не обнаружено образование другого изомера.
Схема механизма реакции А Е
π –комплекс σ- комплекс-карбокатион
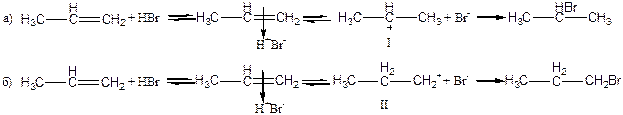 π –комплекс σ- комплек-карбокатионс
π –комплекс σ- комплек-карбокатионс
Донорные заместители увеличивают скорости реакций присоединения., а акцепторные – снижают, так как уменьшают электронную плотность в области двойной связи и затрудняют притяжение электрофильной частицы при образовании π –комплекса.
Сравним относительные скорости реакций присоединения брома к двойной связи:
Этен 1, 0 ( стандарт)
Пропен 3, 0
Метилпропен( изобутен) 5, 5
2-метилбутен-2 10,4
Бромэтен 0,04 ( + М < - I )
В организме с участием ферментов непрерывно протекают реакции присоединения воды к двойной связи. Эти процессы связаны с энергетическим обменом ( реакции цикла Кребса), синтезом и окислением высших карбоновых кислот. Реакции стереоспецифичны, что означает - образуется только один стереоизомер.
Фумаровая кислота + Н2О ——> D- яблочная кислота
СООН
Н СООН |
> С=С < Н –С – ОН
НООС Н |
СН2
|
СООН
Гидратация активных форм 2,3-непредельных кислот всегда приводит к получению 3-гидроксипроизводных ( ß -гидроксикарбоновых кислот).
СН 3 – СН = СН – СООН + Н2О ——> СН 3 – СН – СН2 – СООН
2-бутеновая кислота | 3-гидроксибутановая
( кротоновая) ОН ( ß –гидроксимасляная )
Задание для самостоятельной работы: запишите строение двух возможных σ –комплексов( карбокатионов), которые образуются при гидратации пропеновой (акриловой) кислоты, обсудите, какой из них более устойчив и сравните ваши выводы с направлением реакции, которая сопровождается образованием 3-гидроксипропановой кислоты.
Дата добавления: 2015-03-26; просмотров: 1103;
