Секреция и действие вазопрессина
Аргинин-вазопрессин (АВП) представляет собой нонапептид, состоящий из 6 аминокислот, замкнутых в кольцо, к которому в виде боковой цепи присоединены еще 3 аминокислоты.
Механизм действия. Действуя на свои V2-рецепторы в дистальных отделах почечных канальцев, АВП препятствует экскреции воды и способствует концентрации мочи путем повышения гидроосмотического тока воды из просвета канальцев через клетки собирательных трубочек в интерстициальное пространство мозгового слоя почек. Именно благодаря этому поддерживается постоянство осмоляльности и объема жидких сред организма. В высоких концентрациях АВП действует на V1-рецепторы, вызывая сужение сосудов, что может иметь место при резкой гипотензии или при инфузии вазопрессина в лечебных целях при кровотечении из варикозно-расширенных вен пищевода.
АВП, секретируемой аксонами, оканчивающимися в головном мозге, может принимать участие в процессах обучения и памяти, а секретируемый волокнами срединного возвышения — влиять на секрецию кортикотропина.
Нормальные уровни гормона. Концентрацию АВП в плазме и моче можно определить радиоиммунологическим методом. Результаты выражают либо в единицах действия, исходя из прессорной активности препарата у крыс, либо в весовых количествах очищенного вазопрессина. Биологическая активность аргинин-вазопрессина составляет примерно 400 ЕД/мг (1 мкЕД=2,5 пг). Гипофиз человека в условиях обычного потребления жидкости содержит около 8 ЕД АВП. В тех же условиях концентрация АВП в плазме периферической крови человека колеблется от 1 до 3 мкЕД/мл. Уровень АВП в крови зависит от времени суток, достигая максимального поздно ночью и рано утром и опускаясь до минимального после полудня. В условиях нормальной гидратации у здорового человека гипофиз за сутки выделяет 400—550 мЕД АВП, а с мочой экскретируется 10—35 мЕД. При 24—28-часовой дегидратации количество секретируемого гормона возрастает в 3—5 раз, что сопровождается повышением его уровня в плазме крови и моче.
Метаболизм. АВП инактивируется в печени и почках преимущественно путем отщепления концевого глицинамида с образованием биологически неактивного вещества. Примерно 7—10% секретируемого АВП выводится с мочой в виде активного гормона. Регуляция секреции АВП (рис. 323-1).
Осморегуляция. В нормальных условиях секрецию АВП регулируют главным образом осморецепторы, расположенные в гипоталамусе. Изменения концентрации растворенных в плазме веществ, не проникающих через клеточную мембрану, сопровождаются изменением объема осморецепторных клеток, что в свою очередь меняет электрическую активность нейронов, контролирующих секрецию АВП. Осмотические сдвиги, стимулирующие секрецию АВП, увеличивают и его образование. Сервомеханизм между секрецией АВП и эффективной осмоляльностью плазмы в норме поддерживает последнюю в очень узких пределах. Средняя осмоляльность плазмы у здорового человека после водной нагрузки в количестве 20 мл/кг массы тела составляет 281,7 мосм/кг, а осмоляльность, запускающая секрецию АВП после введения гипертонического солевого раствора на фоне водной нагрузки, — 287,3 мосм/кг. Таким образом, при переходе от полного диуреза до начала антидиуреза под действием гипертонического раствора соли осмоляльность плазмы меняется всего на 5,6 мосм/кг, или на 2%.
Инфузия гипертонического солевого раствора с постоянной скоростью человеку в условиях водной нагрузки приводит к линейному возрастанию осмоляльности плазмы во времени. Однако через какой-то срок, продолжительность которого зависит от скорости инфузии и концентрации солевого раствора, происходит крутое и прогрессирующее падение клиренса свободной воды без сколько-нибудь заметного изменения экскреции растворенных веществ или креатинина. Мы определили осмотический порог для секреции АВП в единицах осмоляльности плазмы к началу антидиуреза в таких условиях. У 73 здоровых испытуемых антидиурез начинался при средней осмоляльности 287 мосм/кг.
Регуляция объемом жидкости. Уменьшение объема плазмы, воспринимаясь рецепторами растяжения в левом предсердии и, вероятно, в легочных венах, стимулирует секрецию АВП путем ослабления топической ингибиторной импульсации из левого предсердия в гипоталамус. Нервные импульсы проходят по блуждающим нервам в ретикулярную формацию среднего и промежуточного мозга и достигают супраоптических и паравентрикулярных ядер, где интегрируются с другими стимулами, влияющими на секрецию АВП. Этот механизм может активироваться положительным давлением в грудной клетке при дыхании, ортостатическим положением тела и расширением сосудов поддей
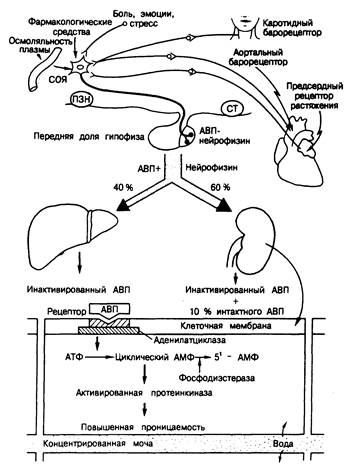
Рис. 323-1. Схематическое изображение регуляции секреции АВП и его клеточного эффекта.
Обозначения: ПЗН — перекрест зрительных нервов, СТ — сосцевидное тело.
ствием высокой окружающей температуры и направлен на восстановление объема плазмы. Иногда он даже преодолевает осмотическое ингибирование секреции АВП. После уменьшения объема плазмы концентрация АВП может в 10 раз превышать тот его уровень, который обусловливается гипертоничностью плазмы. Увеличение объема плазмы ингибирует секрецию АВП за счет противоположных механизмов, вызывающих диурез и коррекцию гиперволемии. Отрицательное давление в грудной клетке при дыхании, горизонтальное положение тела, отсутствие силы тяжести (что имеет место при космических полетах), погружение в воду и воздействие холода — все это может активировать данный механизм.
Барорецепторная регуляция. Активация каротидных и аортальных барорецепторов в ответ на гипотензию вызывает секрецию АВП. Гипотензия, обусловленная кровопотерей, является наиболее сильным стимулом и иногда сопровождается повышением уровня АВП в плазме до 1000 мкЕД/мл. Такая концентрация АВП может вызывать резкое сужение сосудов, что, по всей вероятности, участвует в нормализации артериального давления.
Нервная регуляция. Стимулирующее и ингибиторное влияние на гипоталамус и, следовательно, на секрецию АВП может опосредоваться нейротрансмиттерами и пептидными нейромодуляторами, такими как ангиотензин II, дофамин и эндорфины. Последним звеном, связывающим нервные пути с нейронами супраоптического ядра, осуществляющими секрецию АВП, является, по-видимому, ацетилхолин. Холинергические и -адренергические стимулы приводят к секреции АВП, тогда как атропин и -адренергическая стимуляция тормозят эту секрецию, действуя, очевидно, на уровне гипоталамуса. Эмоциональный стресс, рвота и боль могут преодолевать диурез. Последний может быть вызван гипнотическим внушением, условнорефлекторно и вдыханием углекислоты.
Старение. Процесс старения сопровождается ростом секреции АВП в ответ на повышение осмоляльности плазмы и прогрессирующим увеличением его концентрации в плазме. Эти физиологические сдвиги, по-видимому, обусловливают у лиц пожилого возраста большую задержку воды в организме и гипонатриемию, несмотря на одновременное снижение максимальной концентрирующей способности почек в ответ на АВП. Эти процессы отмечаются у лиц старше 60 лет и с возрастом прогрессируют.
Фармакологические влияния. К фармакологическим средствам, стимулирующим секрецию АВП, относятся никотин, морфин, винкристин, винбластин, циклофосфамид, клофибрат, хлорпропамид и некоторые трициклические противосудорожные вещества и антидепрессанты. Этанол обладает диуретическими свойствами и ингибирует функцию нейрогипофиза. Секрецию АВП ингибируют и некоторые антагонисты наркотиков. В условиях эксперимента хлорпромазин резерпин и фенитоин уменьшают выход АВП из гипофиза и увеличивают его экскрецию с мочой, что приводит к потере жидкости. У человека фенитоин и хлорпромазин также могут ингибировать секрецию АВП и стимулировать диурез.
Реакция АВП на обезвоживание и водную нагрузку. В условиях лишения организма воды возникают как осмотический, так и объемный стимулы к секреции вазопрессина, поскольку при этом увеличивается осмоляльность плазмы и уменьшается ее объем. Максимальная величина осмоляльности мочи при сухоядении варьирует в зависимости от осмоляльности мозгового слоя почек и других внутрипочечных факторов. У здоровых лиц лишение воды в течение 18—24 ч редко приводит к повышению осмоляльности плазмы более 292 мосмоль/кг. Возникающая при этом стимуляция секреции АВП увеличивает его концентрацию в плазме до 6— 10 мкЕД/мл.
Прием жидкости снижает осмоляльность плазмы и увеличивает объем крови, тормозя секрецию АВП через осморецепторный и предсердный волюморецепторный механизмы. Пероральная водная нагрузка в количестве 20 мл/кг приводит у здорового взрослого человека к падению осмоляльности плазмы в среднем до 281,7 мосмоль/кг и в пределах 1—1,5 ч вызывает максимальный диурез, при котором клиренс свободной воды возрастает примерно до 12 мл/мин, а осмоляльность мочи снижается до 40—60 мосмоль/кг. Запаздывание максимального диуреза объясняется тем, что для всасывания воды в кишечнике, разрушения ранее выделившегося вазопрессина и высвобождения почек из-под его действия необходимо время.
Взаимодействие осмотических и объемных стимулов. Как в условиях лишения воды, так и при водной нагрузке объемное и осмотическое влияние на секрецию АВП действуют параллельно. В других ситуациях эти факторы могут конкурировать друг с другом, и небольшие сдвиги в объеме плазмы модифицируют гипертонический стимул к секреции АВП. Обычно осмотические факторы играют основную роль в удержании осмоляльности плазмы в узких границах. Большие изменения в объеме крови (например, при кровотечении) могут демпфировать и даже преодолевать осмотические влияния. Точно так же и гипотензия, активируя барорецепторы, оказывает мощное стимулирующее действие на секрецию АВП, преодолевая, таким образом, одновременные ингибирующие влияния.
Связь между секрецией АВП и потреблением воды, обусловленным жаждой. В нормальных условиях между секрецией АВП и жаждой существует тесная связь, причем и та, и другая регулируются небольшими подъемами и снижениями осмоляльности плазмы. Чувство жажды возникает обычно при возрастании осмоляльности плазмы выше 292 мосмоль/кг. В эксперименте жажда и секреция АВП увеличиваются под влиянием ангиотензина II. При нарушении секреции АВП потеря воды обусловливает гипернатриемию, которая усиливает жажду и потребление жидкости в степени, достаточной для восстановления и сохранения осмоляльности плазмы. С другой стороны, утрата чувства жажды (адипсия) сопровождается некорригируемыми потерями жидкости и гипернатриемией, несмотря на возрастание секреции АВП и экскрецию максимально концентрированной мочи.
Влияние глюкокортикоидов. Гормоны коры надпочечников и задней доли гипофиза оказывают противоположное влияние на экскрецию воды. Кортизол повышает осмотический порог секреции АВП, вызываемой инфузией гипертонического солевого раствора здоровым людям в условиях водной нагрузки. Глюкокортикоиды защищают организм от водной интоксикации и нормализуют нарушенную при недостаточности надпочечников реакцию на водную нагрузку.
Хотя снижение способности разводить мочу у больных с недостаточностью надпочечников отчасти может быть следствием повышенного уровня АВП в крови, глюкокортикоиды оказывают и прямое действие на почечные канальцы, снижая их проницаемость для воды и увеличивая экскрецию бессолевой воды даже в отсутствие АВП.
Клеточные механизмы активности АВП. Биохимическая основа действия АВП на почечный каналец отражена на рис. 321-1. 1)АВП связывается со специфическими рецепторами V2 на контралюминальной поверхности канальцев; 2) гормонрецепторный комплекс «сопрягается» с аденилатциклазой через белок, регулируемый гуаниннуклеотидом (см. гл. 67), и активирует ее, причем это происходит на той же контралюминальной поверхности;
3) возрастает продукция циклического АМФ; 4) циклический АМФ перемещается к люминальной мембране клетки, где активирует связанную с этой мембраной протеинкиназу;
5) активированная протеинкиназа обусловливает фосфорилирование мембранных белков и 6) увеличивается проницаемость люминальной мембраны по отношению к воде. Образовавшийся под действием АВП циклический АМФ может инактивироваться фосфодиэстеразой, превращающей его в 5'-АМФ. АВП стимулирует также продукцию простагландина Е2 который в свою очередь действует в качестве ингибитора системы активации аденилатциклазы по механизму обратной связи.
Перемещение воды через каналец зависит от целостности системы микротрубочек в эпителиальных клетках. Перечисленные выше биохимические процессы приводят к пассивному току воды по осмотическому градиенту через стенку собирательного канальца. Физиологическое действие АВП сопровождается анатомическими изменениями, к которым относятся набухание клеток, их вакуолизация, увеличение интерстициального пространства в мозговом веществе почек и расширение межклеточных пространств в собирательных протоках. Последнее указывает на то, что реабсорбция жидкости при вызванном АВП антидиурезе осуществляется отчасти и через межклеточные каналы.
На действие АВП могут влиять различные катионы и фармакологические средства. Кальций и литий уменьшают реакцию аденилатциклазы на вазопрессин. Литий препятствует также осуществлению последующих биологических процессов. Аналогично и влияние недостаточности калия. Демеклоциклин ограничивает степень вазопрессиновой стимуляции аденилатциклазы и ингибирует также цАМФ-зависимую протеинкиназу. В отличие от этого хлорпропамид усиливает вазопрессиновую активацию аденилатциклазы.
Дата добавления: 2015-03-17; просмотров: 1113;
