ОНКОГЕНЫ И НЕОПЛАСТИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Поль Нейман (Paul Neiman)
При делении раковые клетки передают дочерним клеткам неопластический фенотип. Но этой причине получило всеобщее распространение мнение о том, что наследование неопластического фенотипа предопределяется специфическими генами. Это предположение объясняет чрезвычайный интерес исследователей-онкологов к онкогенным вирусам. Несмотря на сравнительную генетическую простоту, они вызывают все патологические и клинические изменения, ассоциированные с неопластическим заболеванием, и в некоторых случаях вирус способен вводить в нормальную клетку единственный ген (онкоген), продукт которого инициирует и поддерживает неопластическое состояние. Онкогены представляют собой измененные формы клеточных протоонкогенов, которые в норме выполняют в клетке важные функции. Человеческие гомологи некоторых из этих онкогенов могут играть определенную роль в раковых заболеваниях человека. Эта ситуация поднимает ряд вопросов относительно природы онкогенов, управления их экспрессией, биохимической природы их генных продуктов и механизмов взаимодействия с метаболизмом клетки-хозяина.
Ретровирусные онкогены. Взаимодействие ретровирусов с клеткой-хозяином. Открытие онкогенов явилось результатом изучения молекулярной биологии РНК опухолевых вирусов (ретровирусов). Ретро-вирусы широко распространены в природе и инфицирование некоторыми из них ассоциируется с новообразованиями у животных; другие же опухолегенными свойствами не обладают. Геном ретровируса представляет собой молекулу РНК длиной от 8000 до 10000 нуклеотидов. Отличительной особенностью жизненного цикла ретровирусов является то обстоятельство, что после проникновения вируса в клетку геномная молекула РНК копируется на ДНК (обратная транскрипция), и ДНК-копия интегрируется с хромосомной ДНК клетки-хозяина (отсюда и название ретровирус) (рис. 59-1). Эта интегрированная ДНК называется провирусом. Структура типичных провирусов схематически изображена на рис. 59-2. Длинные терминальные повторы (ДТП) содержат последовательности, скопированные с обоих концов геномной РНК вируса, размещены на каждом конце ДНК провируса н сцеплены непосредственно с ДНК хозяина. ДТП содержат последовательности, регулирующие экспрессию генов при репликации вирусов: gag кодирует внутренние структурные белки, pol— обратную транскрнптазу, env — гликопротеин вирусной оболочки. В регуляторные последовательности включены сигналы инициации и терминации транскрипции. Обычно они содержат также могучий ген-усилитель, способный настолько повысить темп транскрипции вирусных генов, что провирусный РНК-транскрипт будет составлять от 0,1 до 1% полного клеточного содержания мРНК. Промоторы и усилители транскрипции обычно включаются лишь в клетках определенного типа, чем и определяется тканеспецифичность вирусных генов. В других случаях активность последовательностей-усилителей реализуется стероидными гормонами. В отличие от многих других вирусов ретровирусы обычно не приводят клетку-хозяина к гибели после завершения репликации; вместо этого они встраиваются в экзогены, вызывают их экспрессию и тем самым меняют фенотип клетки-хозяина.
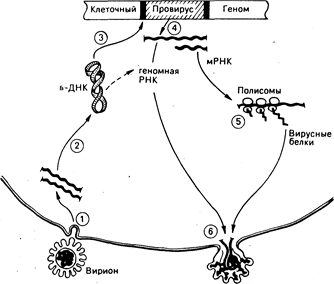
Рис. 59-1. Репликация ретровирусов.
(1) Оболочечный гликопротеин на поверхности вирусных частиц (вирионов) опознает рецепторы, способствующие входу в клетку, и освобождает вирусную геномную РНК.
(2) Каждый вирион содержит две молекулы вирусной РНК, которые в клетке копируются обратной транскриптазой в циклические скрученные молекулы вирусной ДНК.
(3) Некоторые из циклических молекул ДНК встраиваются в хромосомную ДНК хозяина в строго определенных точках молекулы вирусной ДНК и в случайном, или почти случайном, сайте хромосомы хозяина. (4) Интегрированная копия вирусной ДНК, или провирус, транскрибируе-тся как в мРНК, которая транслируется на клеточных полисомах в вирусные белки (5), так и в полимерную геномную вирусную РНК, которая содержит специфические последовательности, служащие сигналами упаковки при сборке вируса. (6) Вирусные РНК и белки собираются в частицы, которые затем покидают клетку. Весь процесс может не сопровождаться цитопатическими эффектами для клетки хозяина.
Остротрансформирующие ретровирусы и их онкогены. Заражение животных ретровирусами, содержащими только гены gag, pol и env, сопровождается новообразованиями лишь после долгого латентного периода. Напротив, остротрансформирующие ретровирусы в считанные дни или недели могут вызвать неоплазию in vivo или привести к перерождению клеток в культуре in vitro. Прототипом этого класса вирусов служит вирус саркомы Рауса. Структура провирусов из этих двух классов онкогенных агентов приведена на рис. 59-2. Почти все известные остротрансформирующие ретровирусы дефективны, т. е. они утратили часть генов, необходимых для репликации, и, следовательно, их распространение возможно лишь путем коинфекции со стандартными ретровирусами-хелперами. Такие дефекты являются результатом замещения репликативных генов вируса на онкоген, который играет роль посредника для. непосредственно трансформирующих свойств вируса. Исключения из этого общего правила представлены некоторыми штаммами вируса саркомы Рауса, которые имеют как репликативные гены, так и онкогены. Хотя конкретный сегмент вирусного генома, который замещается на онкоген, может варьировать, общая конфигурация остротрансформирующих вирусов такова, как это показано на рис. 59-2. В этом случае онкоген спаян с 5`-областью вирусного гена gag, в результате чего синтезируется трансформирующий белок с пептидами gag в аминотерминале.
В табл. 59-1 приводится список некоторых вирусов онкогенов, их природных хозяев и типов опухолей, которые они вызывают. В случае вируса саркомы Рауса роль гена src в неопластических трансформациях была установлена средствами генетики и биохимии. Известны мутации, вызывающие обратимую инактивацию продуктов гена src при повышении температуры (так называемые температурочувствительные мутации). Эти мутации переводят трансформированный фенотип в нормальное состояние, если инфицированные клетки подвергаются воздействию повышенной температуры. При понижении температуры клетки снова возвращаются в трансформированное состояние. Аналогичные, хотя и не столь полные, данные получены и для других вирусов, перечисленных в табл. 59-1.
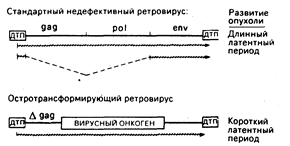
Рис. 59-2. Сравнительные структуры провирусов со стандартной компетентной репликацией и остро трансформирующих ретровирусов. В обоих случаях провирус окаймлен прямыми последовательностями длинных терминальных повторов (ДТП), которые содержат основные элементы регуляции: включая промоторы и усилители транскрипции, сигналы терминации транскриптов вирусной РНК (сигналы добавки поли-А) и сигналы интеграции в ДНК хозяина. Между ДТП стандартного ретровируса находятся три гена: gag (внутренние структурные белки), pol (обратная транскриптаза) и env (гликопротеин оболочки), которые необходимы для инфекции и репликации. У остротрансформирующих вирусов все или часть репликативных генов замещены трансформирующим онкогеном, который и определяет онкогенные свойства вируса. Наиболее общей структурой является спайка 5'-участка гена gag с онкогеном. Стандартный провирус транскрибируется в полномерную вирусную РНК и в мРНК для синтеза вирусных белков. Остротрансформирующий провирус часто экспрессирует только один сайт РНК-транскрипта. В этом случае репликация дефективна и для размножения требуется коинфекция со стандартным ретровирусным «хелпером». Символ Agag означает, что часть последовательности gag исчезла в результате делеции.
Почти все трансформирующие вирусы могут быть обнаружены in vitro по их способности вызывать перерождение клеток в культуре. Стандартный тест состоит в формировании инфицированными фибробластами (или линиями фибробластоподобных клеток) морфологически измененных клеток. Некоторые из порождающих лейкемию вирусов могут трансформировать макрофаги и/или кроветворные клетки in vitro.
Протоонкогены. Онкогены ретровирусов находятся в близком родстве с нормальными генами клеток. Это родство было установлено в результате открытия гомологичности в нуклеотидных последовательностях трансформирующего онкогена вируса саркомы Рауса v-src (вирусного src) и нормального гена цыпленка с-сгс (клеточного src). Очевидно, вирус саркомы Рауса явился результатом рекомбинаций между c-src и древним стандартным ретровирусом птиц. Такой механизм — рекомбинация между вирусным геном и геном хозяина — служит очевидным объяснением образования трансформирующих вирусов (см. табл. 59-1). По этой причине функции нормальных генов и их роль в невирусных новообразованиях вызывают повышенный интерес исследователей.
В природе нормальные формы онкогенов весьма консервативны. Для каждого из них существуют человеческие гомологи, а гомологи некоторых из них присутствуют во всех эукариотических организмах, до беспозвоночных и дрожжей включительно. Такой консерватизм наводит на мысль, что эти гены выполняют в нормальных клетках жизненно важные функции, и предполагает, что онкогенный потенциал приобретается генами только после функционально значимых изменений (таких, например, какие происходят при рекомбинации с ретровирусом). О таких генах говорят как о протоонкогенах (с-оnс).
Таблица 59-1. Вирусные онкогены, вызывающие острые трансформации
| Название | Вирус | Опухоли in vivo |
| Цыплята | ||
| Src | Вирус саркомы Рауса | Саркомы |
| Yes | Вирус саркомы Y73 | Саркомы |
| fps/fes | Вирус саркомы Fujinami | Саркомы |
| Ros | Вирус птичьей саркомы UR11 | Саркомы |
| erb/B | Вирус птичьего эритробластоза (AEV) | Эритроидный лейкоз |
| Myb | Вирус птичьего миелобластоза. (AMV) | Миелоидный лейкоз |
| my с | Вирус птичьего миелоцитоза (МС-29) | Лейкоз, эндотелиом а |
| Sci | Птичий вирус SKV/770 | Неизвестно |
| Индюки | ||
| rei | Вирус ретикулоэндотелиоза (REV) | Лимфомы |
| Мыши | ||
| abl | Вирус лейкоза Abelson | В-л и мфо мы |
| nios | Вирус мышиной саркомы | Саркомы |
| Молони (MoMSV) | ||
| fos | Вирус остеосаркомы FBj | Остеосаркома |
| raf | Вирус мышиной саркомы 3611 | Саркомы |
| Крысы | ||
| Ha-ras-1 | Вирус мышиной саркомы | Саркомы, эритроид- |
| Гарвея (HaMSV) | ный лейкоз | |
| Ki-ras-2 | Вирус мышиной саркомы | Саркомы, эритроид- |
| Кирстена (KiMSV) | ный лейкоз | |
| Кошки | ||
| fes/fps | Вирус кошачьей саркомы | Саркомы |
| Snyder Thieien ST-FeSV | ||
| fins | Вирус кошачьей саркомы | Саркомы |
| McDonough (SM-FeSV) | ||
| I'gr | Вирус кошачьей саркомы | Саркомы |
| Gardner Rasheeds (GR-teSV) | ||
| Обезьяны | ||
| sis | Вирус обезьяньей саркомы | Саркомы |
| (SSV) |
Нуклеотидные последовательности белков кодирующих областей вирусных онкогенов отличаются от таковых для протоонкогенов. Существуют также принципиальные различия в регуляции экспрессии вирусных и клеточных генов. Например, нормальные клеточные формы онкогена могут экспрессироваться без трансформации клетки, хотя обычно экспрессия протекает на более низком уровне, и/или с более жесткой регуляцией, чем .для вирусных онкогенов, экспрессируемых провирусами. Относительные вклады сверхэкспрессии, измененной регуляции и структурных мутаций в трансформирующую активность вирусных онкогенов не вполне ясны. Все эти элементы могут обладать той или иной степенью важности в зависимости от конкретного онкогена и типа клетки-мишени.
Инфицирование ретровирусами, не содержащими онкогенов, может вызвать новообразования у некоторых животных, но после долгого латентного периода. Общим механизмом такой онкогенной активности является активация клеточных протоонкогенов, на что указывает образование лимфом в фабрициевой сумке цыплят, зараженных вирусом лейкоза птиц (ВЛП). При этих новообразованиях протоонкоген, называемый с-тус, экспрессируется с высоким уровнем в результате интеграции промотора-усилителя ВЛП-генома вблизи с-mус. Тот факт, что эти опухоли клонируются и активация с-тус наблюдается только в опухолевых клетках, вкупе с известным онкогенным потенциалом v-myc подтверждает идею- о том, что с-тус играет важную роль в образовании этих опухолей. В табл. 59-2 приведен список протоонкогенов, о которых известно, что они активируются в порождаемых ретровирусом опухолях с большим латентным периодом. Некоторые из-них (myc, erb В) гомологичны известным вирусным онкогенам. Другие (Int-1, Int-2, Pim-1, Mlvi-1, Mlvi-2) не идентифицированы как части геномов остротрансформирующих вирусов. Их онкогенный потенциал выводится по аллелям.
Таблица 59-2. Протоонкогены и предполагаемые протоонкогены, активирующиеся в опухолях путем интеграции с ретровирусными провирусами
| 'In кvr- или t'l! MIl'ni'Hb | Вирус | Опухоль |
| е-in ус | Вирус птичьего лейкоза | Лимфомы В-клеток (цыплята) |
| .'-туе | Вирус кошачьего лейкоза | Лимфомы (кошки) |
| с-ту с | Вирус мышиного AKR-лейкоза | Лимфомы Т-клеток (мыши) |
| .•-erb В | Вирус птичьего лейкоза | Эритроидный лейкоз (цыплята) |
| ^пп-1 | Вирус мышиного AKR-лейкоза | Лимфома Т-клеток (мыши) |
| Vlbvi-1 | Вирус мышиного лейкоза Молони | Лимфома Т-клеток (крысы) |
| Vlbvi-2 | Вирус мышиного лейкоза Молони | Лимфома Т-клеток (крысы) |
| iit-1 | Вирус опухоли молочной железы мыши | Аденокарцинома молочной железы (мыши) |
| nt-2 | Вирус опухоли молочной железы мыши | Аденокарцинома молочной железы мыши |
Ретровирусы человека. Вирусы лейкоза Т-клеток человека (HTLV) являются ретровирусами, реплицирующимися преимущественно в лимфоцитах человека. Инфицирование HTLV типа I ассоциировано с развитием специфического типа лейкемии Т-клеток у взрослых, которая с нарастающей частотой встречается в южной Японии и странах Карибского бассейна. Инфицирование in vitro штаммом HTLV-I культуры Т-клеток человека подтверждает способность вызывать рост независимо от экзогенных факторов роста Т-клеток (иммортализация). Инфицирование другим вирусом, называемым HTLV-III, ассоциируется с синдромом приобретенного иммунодефицита. То же самое справедливо для вируса LAV, ранее ассоциированного с лимфаденопатией. По-видимому, HTLV не содержат клеточно-зависимых онкогенов. Вместо этого они меняют поведение клетки-хозяина уникально взаимодействующими вирусными регуляторными белками.
Нормальная человеческая ДНК содержит структуры, которые могут оказаться провирусами и генетически передаются половыми клетками. Значимость таких структур неизвестна.
Активированные клеточные онкогены, детектируемые трансфекцией. Трансфекционный тест на онкогены. Некоторые из известных клеточных линий обладают способностью инкорпорировать экзогенную ДНК в свой хромосомный аппарат с такой эффективностью, что появляется возможность экспериментального введения гена (трансфекции) непосредственно в культуру тканей. Технология трансфекции обычно заключается в осаждении ДНК на поверхность клеток-мишеней фосфатом кальция с последующим поглощением ДНК внутрь клетки посредством пиноцитоза. Некоторые из поглощенных молекул ДНК транспортируются в клеточное ядро и интегрируются в хромосомную ДНК. Если трансфектированная ДНК содержит ген, который может экспрессироваться в клетке-реципиенте как доминантный селектируемый маркер, то клетки, экснрессирующие этот признак, могут быть обнаружены в культуре с эффективностью до одной клетки на каждые 105 событий трансфекции. Многие из вирусных онкогенов. (см. табл. 59-1) могут вызвать трансформации в тестах описанного типа. Трансформация такого рода имеет место как при использовании чистой онкогенной ДНК, так и при использовании хромосомной ДНК клеток, трансформированных ретровирусами.
Таблица 59-3. Онкогены, обнаруженные в опухолях человека трансфекцией клеток NiH/3ТЗ
| Онкоген | Опухоли или опухолевые линии клеток |
| с-гас" | Линии клеток из, карциномы мочевого пузыря EJ/T24, карциномы легкого и карциносаркомы молочной железы |
| c-racк | Карциномы легкого, толстой кишки, мочевого пузыря, поджелу- |
| гacN | Нейробластома, фибросаркома, промиелоцитарный и острый мие-лоцитарный лейкоз, лимфома Беркитта и карцинома толстой кишки |
| HuBlym-1 | Несколько линий клеток из лимфомы Беркитта |
| Tlym-1 | Линии клеток из Т-клеточной лимфомы' |
Клонированный ген Tlym-1 мышиного происхождения. Судя по паттернам инактивации рестриктазами, аналогичный трансформирующий ген активирован в линиях из Т-клеточных лимфом человека.
С помощью данной технологии можно обнаружить также активированные клеточные онкогены в ДНК опухолей, вирусная природа которых не доказана. Например, трансформирующие гены содержатся в ДНК химически трансформированных клеток животных и в ДНК клеток разнообразных опухолей человека и животных нативного происхождения. Нормальная высокомолекулярная ДНК человека не трансформирует клеток, однако трансформирующие гены можно активировать фрагментацией нормальной клеточной ДНК. Эти результаты подтверждают концепцию об активации протоонкогенов нормального генома при формировании опухоли, но они ничего не говорят о том, является ли активация трансформирующих генов причиной или следствием неопластического фенотипа. Хотя лишь небольшая часть ДНК опухолей человека проявляет трансформирующие свойства при трансфекции, эти наблюдения открывают новые пути исследования молекулярной генетики новообразований человека.
Семейство клеточных онкогенов ras. Некоторые из трансформирующих генов, обнаруженные путем трансфекции клеток с помощью ДНК, взятой из клеток опухолей человека, в настоящее время идентифицированы (табл. 59-3). В основном эти онкогены принадлежат к семейству генов, называемому «гас». Первым был идентифицирован человеческий гомолог онкогена вируса мышиной саркомы Гарвея (см. табл. 59-1), названный с-гасВ, кодирующий белок с мол. массой 21 000, названный р21. Этот онкоген был активирован в линии клеток, выделенных из карциномы мочевого пузыря человека. Уровень экспрессии белка р21 в клетках, Трансформированных вирусом сарком.ы Гарвея, достаточно высок, и высокоуровневая экспрессия с-гасВ, вызываемая в эксперименте сцеплением этого клеточного гена с вирусными регуляторными элементами, достаточна для индуцирования трансформации клеток. Однако в тех линиях клеток опухолей человека, в которых с-rасВ обнаруживается, он не проявляет высокого уровня экспрессии. Вместо этого способность к трансформации клеток определяется, по-видимому, точечными мутациями, которые приводят к подмене аминокислот в 12-й или 61-й аминокислотной позиции белка р21. Таким образом, этот протоонкоген активируется либо изменением регуляции, либо мутациями в структуре белка.
Чаще активирован в человеческих опухолях второй ген семейства гас— человеческий гомолог трансформирующего гена вируса мышиной саркомы Кир-стена, названный с-гас Около 10—20% ДНК из различных новообразований человека содержит ген с-rасВ, трансформирующий клетки при трансфекции (см. табл. 59-3). Белок, кодируемый геном с-rасВ,—это та же самая молекула р21, и его трансформирующая активность связывается со структурной мутацией белка, подобной той, что наблюдается для гена с-rасВ. Эта мутация отсутствует в ДНК, извлеченной из нормальных тканей больных, пораженных карциномами, которые содержат активированный ген с-rасВ; это обстоятельство свидетельствует, что активация является соматическим событием, происходящим в процессе формирования опухоли. И наконец, в других экспериментах с трансфекцией ДНК, извлеченной из некоторых опухолей, трансформация индуцируется третьим членом этого семейства, называемом rasN Активация rasN имеет место в 10—20% случаев острых миелоидных лейкемий человека.
Активация генов ras обычна для некоторых химически индуцированных эпителиальных карцином у грызунов, что предполагает активацию этих генов химическими карциногенами. Однако у человека активированные ras-гены найдены лишь в небольшой части опухолей. Это означает, что в человеческих опухолях имеют место еще не идентифицированные изменения генов ras, либо то, что в процессе развития опухолей вместо изменения генов ras происходит изменение других генов. Ни одна из этих вероятностей не может быть определена посредством стандартных опытов по трансфекции. Возможна и другая альтернатива — активация всех онкогенов может оказаться результатом неопластического состояния, а не его первопричиной. Формального доказательства причинной роли активированных ras-генов в тех опухолях человека, в которых они обнаруживаются, не имеется.
Возможные клеточноспецифические онкогены. В отличие от генов семейства ras, проявляющих активность при новообразованиях многих типов, активация других онкогенов может оказаться специфичной для неопластических состояний клеток определенного типа. Первым из этой группы был идентифицирован ген, названный ChBlym-1. ДНК из лимфом цыплят, индуцированных вирусом птичьего лейкоза, трансформирует клетки при трансфекции, в то время как ДНК из нормальных тканей тех же самых птиц этим свойством не обладает. Ген Ch Blym-1, который, как полагают, отвечает за эту активность, был получен из клеток, трансформированных ДНК, выделенной из клеточных линий лимфомы фабрициевой сумки. Этот ген, по-видимому, не имеет отношения к ras или другим вирусным онкогенам, описанным в 'табл. 59-1. Как и для других онкогенов, нуклеотидные последовательности ChBlym-1 законсервировались в процессе эволюции и постоянно присутствуют в ДНК человека.
Как. и вирусиндуцированные лимфомы цыплят, человеческая лимфома Беркитта состоит из тех же самых В-клеток, находящихся примерно на той же стадии дифференциации. ДНК, извлеченная из клеток большинства линий лимфомы Беркитта, может трансформировать клетки при трансфекции. Это свойство объясняется, по-видимому, активностью гена, называемого HuBlym-1, который на уровне последовательностей ДНК на 50% гомологичен гену ChBlym-1. Таким образом, онкогены Blym активированы в В-клеточных лимфомах как цыплят, так и людей, но в опухолях других типов их не обнаруживают. Поскольку характеристики нормальных гомологов этих трансформирующих генов неизвестны, то неизвестны и молекулярные причины их активации.
Другие В- и Т-клеточные новообразования и аденокарциномы молочной железы содержат трансформирующие гены, которые, похоже, различны для каждого типа опухоли. Например, трансформирующий ген новообразований с промежуточной стадией дифференциации Т-клеток, называемый Tlym-t, отличен от других известных онкогенов.
Онкогены, участвующие в образовании опухолей, вызываемых хромосомными транслокациями и другими перестройками. Третья волна свидетельств об активации, онкогенов в процессе формирования опухоли возникла из анализа цитогенетических изменений в новообразованиях человека. Большинство опухолей человека являются клональными, или олигоклональными, т. е. в популяции составляющих их клеток доминирует потомство одной или нескольких клеток. В определенных новообразованиях доминантные клеточные клоны маркированы существенными хромосомными аномалиями, такими, например, как реципрокные гранслокации между хромосомами 9 и 22 при хроническом миелогенном лейкозе (с образованием филадельфийской хромосомы, Рh') или между хромосомами 8 и 14 в случае лимфомы Беркитта. В настоящее время характеристические неслучайные хромосомные изменения идентифицированы для многих новообразований. Гены, находящиеся в сайте перестроенной ДНК или рядом с ним и являющиеся первопричиной этих цитогенетических изменений, могут играть определенную роль в развитии опухолей. Успехи гибридизации in situ и других методов генетики соматических клеток дали возможность определить приблизительные положения ряда протоонкогенов в хромосомах человека (табл. 59-4). Некоторые из этих генов расположены вблизи точек разрыва хромосом, трансформируемых при определенных опухолях.
Таблица 59-4. Локализация некоторых протоонкогенов в хромосомах человека
| Ген | Хромосома | Суб-локализация в хромосоме или зона' |
| с-тус | q24 | |
| с-аЫ | ||
| c-mos | q22 | |
| c-fes | q24—q25 | |
| c-myb | q22—q24 | |
| c-mil (raf) | р25 | |
| N-ras | cen-^p21 | |
| c-ras" | р14.1 | |
| c-ras" | р 12.05-^ter | |
| c-etc | q23—q24 | |
| c-erbB | pter-^q22 | |
| c-erbA | q21—q22 | |
| HuBlum-1 | p32 | |
| c-fms | q34 | |
| c-fos | q21-^q31 | |
| c-ski | NA | |
| c-sis | qll-^ter | |
| c-src-1 | p34—p36 | |
| c-src-2 | ql2^ter |
q — длинное плечо хромосомы, р — короткое плечо хромосомы, сеn — центромер, ter терминал, NA — неизвестно.
Перестройка локуса с-mус в клетках лимфомы Беркитта. Как показано в табл. 59-4, c-myc ген человека расположен на хромосоме 8. Эта хромосома неизменно участвует в транслокации клеток лимфомы Беркитта. На уровне ДНК транслокация состоит в рекомбинации между c-myc локусом хромосомы 8 и локусом гена иммуноглобулина, расположенного обычно вблизи гена тяжелой цепи в хромосоме 14 или, реже, вблизи гена легкой цепи в хромосомах 2 или 22. По-видимому, эта транслокация не влияет на ту часть c-myc локуса, которая кодирует белок, но воздействует на регуляцию его экспрессии. Аналогичные транслокации, приводящие к рекомбинации между c-myc и генами иммуноглобулина имеют место и в плазмацитомах мышей.
Альтерации экспрессии гена с-abl в результате хромосомной транслокации при хроническом миелолейкозе. У большинства больных с хроническим миелолейкозом (ХМЛ) хромосома Рh' присутствует как в пораженных клетках, так и в поколениях нормальных клеток костного мозга. Считается, что при этом заболевании костный мозг и периферическая кровь заселены потомками кроветворной стволовой клетки, которые сохраняют способность дифференцироваться в красные кровяные клетки, мегакариоциты и гранулоциты. Однако пролиферация гранулоцитов аномальна и чрезмерна, что и вызывает клинические проявления ХМЛ. Гены, экспрессия которых альтерируется вследствие формирования филадельфийской хромосомы, должны рассматриваться как возможные виновники развития ХМЛ. Человеческий гомолог протоонкогена с-abl (см. табл. 59-1) расположен вблизи точки разрыва хромосомы 9 при транслокации 9—22 и при обмене переходит в хромосому 22. Оказалось, что в Рh`-хромосоме экспрессия с-аЫ претерпевает количественные и качественные изменения. Уровни c-abl РНК возрастают, а оба предоминантных РНК-транскрнпта гена и с-аЫ белка становятся больше, чем c-abl РНК и белковые молекулы нормальных клеток. Полагают, что РНК и белковые продукты c-abi локуса клеток ХМЛ включают в себя совокупный продукт c-abi и гена, называемого bcr (breakpoint claster region — область разрывного кластера), расположенного в точке разрыва на рекомбинантной Рh`-хромосоме Если эта альтерация c-abi и играет роль в развитии ХМЛ, то это должно проявляться на ранней стадии заболевания.
Амплифицированные протоонкогены в опухолях человека. Увеличение числа копий гена на клетку (амплификация гена) иногда проявляется на цитогенетическом уровне формированием небольших хромосомоподобных структур, называемых двойными малыми хромосомами, или появлением гомогенно окрашенных участков (ГОУ) в регуляторных хромосомах. ГОУ появляется в результате амплификации сегментов ДНК до такой степени, что это обнаруживается цитогенетически. Как следствие такая структура содержит множественные копии гена (генов), закодированных в данном сегменте ДНК. В нетрансформированных клетках амплификацию гена можно иногда индуцировать выращиванием клеток в специальных условиях. Например, клетки с амплифицированным геном дигидрофолатредуктазы, которая необходима для репликации ДНК, можно получить, если выращивать их (с последующим отбором) в присутствии небольшого количества метотрексата— ингибитора дигидрофолатредуктазы. При увеличении числа копий гена возрастает производство фермента в клетке и тем самым компенсируется действие ингибитора. Двойные малые хромосомы и ГОУ присутствуют во многих разновидностях опухолевых клеток, так что можно предположить, что гены, критические для роста неопластических клеток, могут амплифицироваться в процессе формирования опухоли.
Первым амплифицированным онкогеном, опознанным в опухолевых клетках человека, был ген c-myc, который экспрессировался на высоком уровне в одном случае промие.лоцитарного лейкоза как в исходных опухолевых клетках, так и в производных линиях клеток. Амплификация c-myc при этом заболевании оказалась редким событием и в других случаях промиелоцитарного лейкоза не наблюдалась. Однако двойные малые хромосомы, амплификация c-myc генов и повышенный уровень c-myc РНК наблюдались в ряде случаев рака желудка и мелкоклеточного рака легкого, а амплификация протоонкогена наблюдалась в двух линиях клеток из карциномы толстой кишки человека. Высокая частота двойных малых хромосом и ГОУ характерны для нейробластом человека. Ген, называемый N-myc и родственный гену c-myc, имеет высокий уровень амплификации и/или экспрессии в большинстве нейробластом, в производных от нейробластом линиях клеток и в других нейроэндокринных опухолях. Степень амплификации и/или экспрессии N-myc может сильно варьировать в пределах популяции опухолевых клеток.
Функция онкогенов. Изучение белков, кодируемых вирусными онкогенами и их нормальными клеточными гомологами, проясняет механизмы функционирования этих генов. Белковый продукт гена v-src вируса саркомы Рауса работает как тирозинпротеинкиназа, ферментная активность которой определяет онкогенные свойства v-src. Белковые продукты пяти других вирусных онкогенов (с шифрами fes/fps, yes, ros, abl, fgr) также оказались тирозинпротеинкиназами. Проблема состоит в том, чтобы идентифицировать ее клеточные белки, которые модифицируются этими киназами и являются критическими для трансформации. Например, в клетках, трансформированных вирусами саркомы Рауса, число клеточных белков модифицируется добавлением фосфатных групп к остаткам тирозина, однако роль таких изменений в онкогенезе не установлена.
Факторы роста и рецепторы. Существенный концептуальный прогресс произошел, в результате сравнения двух различных направлений исследования: механизмов функционирования онкогенов и механизмов функционирования фактора роста (рис. 59-3). Пролиферация и дифференциация нормальных клеток регулируется сигналами, поступающими от связей факторов роста с рецепторами на поверхности клеток. Наиболее изучены два фактора роста: тромбоцитарный фактор роста (ТФР), стимулирующий рост клеток соединительной ткани и гладких мышц, и эпидермальный фактор роста (ЭФР), необходимый для оптимального роста эпителиальных клеток in vitro. Рецепторы ТФР и ЭФР содержат тирозинпротеинкиназу, которая активируется связыванием с одним или с другим фактором роста соответственно. Имеют ли тирозинпротеинкиназы рецепторного и онкогенного происхождения общие белковые мишени внутри клеток, неизвестно.
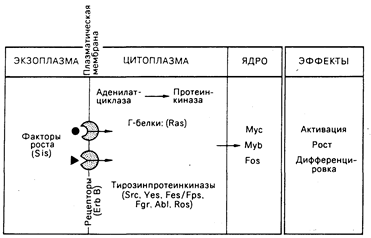
Рис. 59-3. Возможное отношение молекулярной биологии факторов роста к функции онкогенов.
Факторы роста — это небольшие молекулы, которые генерируют сигналы активации, репликации и дифференциации клетки, связываясь со специфическими рецепторами на поверхности клетки-мишени. Как показано, многие белки, производимые онкогенами, соответствуют генеральным путям активности фактора роста. Занимая на этих путях определенные позиции, онкогены могут трансформировать клетку, передавая конститутивные нерегулируемые сигналы роста. Подробности в тексте.
Белок, кодируемый онкогеном вируса саркомы обезьян sis, состоит в близком родстве с ТФР. Онкоген erb/B вируса эритробластоза птиц является, по-видимому, усеченной формой молекулы рецептора для ЭФР. Онкоген fms одного из штаммов вируса кошачьей саркомы может оказаться родственным рецептору фактора роста макрофагов, называемому CSF-1. Эти наблюдения позволяют предположить, что нерегулируемый рост при неопластических трансформациях определяется сигналом, поступающим от изменений в факторах роста, их рецепторах или в промежуточных элементах.
Белки онкогена ras. Белки, кодируемые онкогеном ras, ассоциированы с внутренней поверхностью клеточной мембраны, их функциональная активность, состоящая в связывании гуанозинтрифосфата (ГТФ), является вкладом в функциональную активность ГТФ-связывающих, или Г-белков. Обнаружено, что Г-белки могут ассоциировать с аденилатциклазным комплексом на внутренней поверхности клеточной мембраны и принимают участие в передаче сигналов от поверхности клетки, что в результате приводит к изменениям уровней внутриклеточных циклических нуклеотидов (см. гл. 67). В дрожжах гены ras действуют через пути аденилатциклазпротеинкиназы. Таким образом, может оказаться, что трансформирующие белки ras относятся к классу измененных Г-белков, передающих конститутивный сигнал роста.
Онкогенные белки в клеточном ядре. Белки, кодируемые тремя онкогенами — myb, myc, fos, — размещаются в клеточном ядре. В некоторых, но не во всех, клетках нормальный гомолог myb экспрессируется в фазе G1 клеточного цикла. Функционирование двух других генов представляется тесно связанным с механизмами действия фактора роста. Если фибробласты с остановленным ростом подвергнуть воздействию ТФР, то начинается экспрессия специфического набора генов (по оценкам, от 10 до 30), включая протоонкогены c-fos и с-mус, и уровни клеточной мРНК этих генов нарастают. Экспрессия с-mус стимулируется также в покоящихся Т- и В-лимфоцитах после воздействия соответствующими митогенами. После вхождения клетки в цикл роста экспрессия с-тус остается практически постоянной. После того как клетка утрачивает способность делиться, как, например, постмитотические, дифференцированные клетки, экспрессия с-тус прекращается. Таким образом, эти протоонкогены могут нормально функционировать как регуляторы «активации» роста и дифференциации клеток и служить ядерными мишенями для сигналов, генерируемых фактором роста. При альтерации или разрегулировании они могут обеспечить определяющий стимул нерегулируемого роста клетки и аномальной дифференциации, что характерно для неопластических состояний. Активность как myc-, так и myb-белков ДНК-зависима, но механизм действия ядерных белков неизвестен.
Экспериментальное введение активных онкогенов в половые клетки и в соматические стволовые клетки тканей. Один из способов исследования онкогенного потенциала опухоль-ассоциированных онкогенов заключается во введении активированных онкогенов в нормальные клетки in vivo и наблюдении за воздействием этих генов на дальнейшее развитие. В оплодотворенные яйцеклетки мышей методом микроинъекций было введено несколько различных генов, определяющих специфичность иммуноглобулина и гормона роста. Введенные «транс-гены» интегрировались в геном потомства и в некоторых случаях экспрессировались в клетках соответствующего типа (например, транс-гены иммуноглобулина экспрессировались преимущественно в В-лимфоцитах).
Введение посредством этой технологии гена Т-антигена из ДНК опухолевого вируса SV 40 в эмбрионы мышей привело к формированию папиллом сосудистой оболочки глаза у взрослых особей. Аналогично введение в эмбрионы мышей измененных с-тус транс-генов, содержащих промотор-усилительные последовательности, выделенных из вируса опухолей молочной железы мышей, вызывало развитие этой опухоли у некоторых из особей. По-видимому, введенный онкоген действовал как предрасполагающий фактор ускоренного развития карцином молочных желез, однако для полного развития опухолей у этих животных нужны, вероятно, какие-то дополнительные факторы.
Введение онкогенов в пригодные для трансплантации стволовые клетки костного мозга и лимфоидных органов было осуществлено путем инфицирования стволовых клеток ех vivo вирусными векторами, содержащими эти гены, с последующей трансплантацией зараженных клеток в ткани соответствующим образом подготовленных хозяев. Введение посредством этой методики гена v-myc в стволовые клетки фабрициевой сумки цыплят привело к образованию пренеопластических пролиферирующих повреждений, предшествующих развитию В-клеточных лимфом. При этом отсутствовала активация трансформирующих генов типа Blym-1, которая наблюдалась при более развитых новообразованиях данного вида. Следовательно, в этой системе активированный онкоген myc может быть ответственным за ранние пренеопластические стадии формирования лимфомы, в то время как для прогресса неоплазмы могут требоваться другие факторы, такие как активация Blym-1.
Онкогены и многостадийный опухолегенез. Рак у человека и химически индуцированные новообразования у животных обычно развиваются как многостадийный процесс, при котором аномальная пренеопластическая клетка разрастается в клеточную популяцию с преобладанием клонов со все более нарастающей злокачественностью. Считается, что эволюции развития опухоли предшествует латентный период, и весь процесс может занять значительную часть времени жизни пораженного индивида. Напротив, остротрансформирующие вирусы несут активированные формы тех онкогенов, которые участвуют в развитии рака невирусного происхождения и индуцируют новообразования в течение дней или недель; такая кинетика наводит на мысль об одностадийном процессе. Это различие может определяться несколькими факторами. Во-первых, многие вирусные онкогены кодируют киназы с многочисленными мишенями в клетке и поэтому могут вызывать резкие изменения, для реализации которых при медленно развивающихся новообразованиях потребовалось бы несколько различных мутаций. Во-вторых, экспрессия вирусных онкогенов управляется мощными регуляторами (промоторами и усилителями в провирусиых ДТП). Трансформирующий потенциал клеточных гомологов тех же самых генов может активироваться механизмами, не вызывающими столь высокого уровня экспрессии, например, точечными мутациями в 12-й или 61-й аминокислотных позициях белков, кодируемых человеческими опухоль-ассопиированными онкогенами ras. В таких ситуациях для образования трансформированного фенотипа может потребоваться согласованная активность нескольких генов, в то время как остротрансформирующие ретровирусы могут породить тот же фенотип за счет очень высокоуровневой нерегулируемой экспрессии всего одного из таких генов.
Эту точку зрения иллюстрируют эксперименты по трансфекции, в которых показана кооперация генов в процессе трансформации культуры клеток фибробластов. Активированные гены ras из клеток человеческой опухоли способны трансформировать иммортализованные линии клегок, но не могут вызвать полной морфологической трансформации первичных культур клеток. В то же время комбинация клонов с активированными генами туе и ras приводит к полной трансформации в первичных культурах клеток. Таким образом, в этой системе гены туе (и другие онкогены, которые сами по себе не альтерируют клетки) могут дополнить трансформирующую активность человеческих онкогенов ras. Однако, когда в активированный онкоген ras встраиваются мощные усилители транскрипции, этот ген может и сам трансформировать первичные культуры фибробластов, предположительно благодаря высокому уровню экспрессии этого онкогена. Таким образом, необходимосгь участия в трансформации многих генов может определяться, в частности, уровнем экспрессии онкогена, и в новообразованиях in vivo может активироваться более одного клеточного онкогена.
Исследование онкогенов и клиническая онкология. Вклад идентификации и анализа человеческих онкогенов в клинику может оказаться весьма значительным и даже революционным. Так, усилия но идентификации и контролю тех факторов питания и окружающей среды, которые могут вызывать или предотвращать рак, в основном опираются на методы эпидемиологии, опыты на животных и клинические испытания, при которых конечным пунктом измерений являются уровни заболеваемости и смертности. Знание же специфических протоонкогенов, служащих мишенями для внешних канцерогенов, и природы наведенных изменений может обеспечить лучшие методы для установления истинной роли кандидатов в канцерогены и для выработки превентивных мер. Новое слово в диагностике может сказать связь молекулярной анатомии неопластических изменений с определенными фазами последовательности клеточных поколений. Примером могло бы служить быстрое обнаружение альтераций с-аbl РНК и/или белка для анализа клеток хронического миелолейкоза. Знание молекулярных механизмов, посредством которых онкогены трансформируют клетки, позволило бы также более точно и специфично определить мишени для фармакологического воздействия.
Дата добавления: 2015-03-17; просмотров: 1014;
