ГЛАВА 62. ВВЕДЕНИЕ В КЛИНИЧЕСКУЮ ИММУНОЛОГИЮ
Бартон Ф. Хайнес, Антоны С. Фаучи (Barton F. Haynes, Anthony S. Fauci)
Фундаментальные исследования в области иммунологии способствовали большим успехам многих клинических дисциплин, таких как аллергология, ревматология, неврология и кардиология. Применение моноклональных антител привело к революционным преобразованиям в области исследований поверхностных антигенов эффекторных и регуляторных клеток иммунной системы и дало возможность получать моноспецифические реагенты фактически к любым мишене-вым молекулам. Выделение, клонирование и секвенирование генов, кодирующих антигенные рецепторы на В-клетках (иммуноглобулины) и Т-клетках (- и цепи Т-клеточного антигенного рецептора) и продукты главного комплекса гистосовместимости (HLA-антигены), позволили иметь в руках исследователей зонды. необходимые для понимания эффекторных функций иммунной системы: многообразия антигенных свойств Т- и В-клеток, индукции аутотолерантности (ареактивность к собственным антигенам организма) и регуляции роста и дифференцировки клеток иммунной системы. Технологические возможности молекулярной биологии дают возможность уже сейчас использовать различные генетические зонды для исследования и получения больших количеств секретируемых молекул (продуктов лимфоцитов — лимфокинов, продуктов моноцитов — монокинов), регулирующих функции иммунокомпетентных клеток. Наконец, открытие человеческих Т-клеточно-лимфотропных вирусов (HTLV), принадлежащих к семейству ретровирусов (см. гл. 293), которые вызывают некоторые формы лейкозов (HTLV типа I — Т-клеточный лейкоз взрослых) и иммунодефицита [HTLV типа III/LAV (вирус, ассоциированный с лимфаденопатией) —синдром приобретенного иммунодефицита (СПИД)], а также анализ генетических механизмов изменений Т-клеточного роста под воздействием HTLV во многом способствовали пониманию некоторых аспектов нормального и патологического роста клеток иммунной системы. Представления о существовании контроля роста и дифференцировки клеток иммунной системы открыли новые подходы к разработке специфических методов терапии заболеваний, связанных с расстройствами иммунорегуляции, среди которых можно назвать аутоиммунные и иммунодефицитные заболевания, а также злокачественные болезни иммунной системы. Цель данной главы — дать представление об основах иммунологии с особым рассмотрением тех принципов, которые помогут с базисных позиций понять многообразные клинико-лабораторные проявления расстройств иммунитета.
Фенотип и функция клеток иммунной системы. Двойственность иммунной системы состоит в сосуществовании происходящих из тимуса (Т-) и из костного мозга или аналога фабрициевой сумки (В-) лимфоцитов, ведущих свое происхождение из общей стволовой клетки. Другие типы клеток, такие как моноциты/макрофаги, играют основную роль в осуществлении индуктивной, регуляторной и эффекторной фаз иммунного ответа. К главным эффекторным и регуляторным клеткам иммунной системы относятся Т-, В-клетки, большие гранулярные лимфоциты и моноциты/макрофаги. Такие нелимфоидные клетки, как нейтрофилы, эозинофилы и базофилы, играют значительную роль в воспалительных реакциях, которые являются результатом активации иммунной системы и поэтому должны также рассматриваться как участники процессов выполнения клетками иммунной системы их функций (табл. 62-1). Количественный состав и распределение иммунокомпетентных клеток в различных тканях являются отражением процессов, связанных с транспортом клеток, их хоминг-характеристик и функциональных способностей. В костном мозге содержатся мультипотентные стволовые клетки, способные обеспечивать рост всем типам кроветворных клеток, а сам орган является основным депо в организме, где происходит созревание В-клеток, моноцитов/макрофагов и гранулоцитов. Т-клеточные предшественники также ведут свое происхождение из костно-мозговых стволовых клеток, однако покидают костный мозг незрелыми и для завершения дифференцировки мигрируют в тимус (хоминг-эффект). Зрелые Т-лимфоциты, В-лимфоциты и моноциты выходят в циркулягорное русло, а затем локализуются в периферических лимфоидных органах (лимфатические узлы, селезенка) и в ассоциированной с кишечником лимфоидной ткани (миндалины, пейеровы бляшки, аппендикс) и сохраняются там до момента активации их чужеродными антигенами. Зрелые миелоидные эффекторные клетки (нейтрофилы, эозинофилы, базофилы) покидают костный мозг и циркулируют в периферической крови или мигрируют в ткани для осуществления эффекторных функций, ассоциированных с ответом на чужеродные антигены (рис. 62-1).
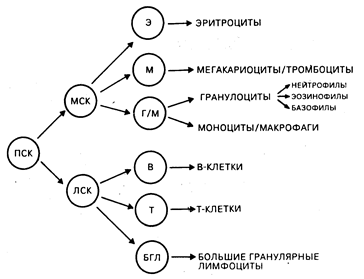
Рис. 62-1. Модель дифференцировки гемопоэтической стволовой клетки. Из гемопоэтической полипотентной стволовой клетки (ПСК) могут происходить более рестриктированные клетки-предшественники со способностью к самообновлению. Таким образом, лимфоцит-коммитированные стволовые клетки (ЛСК) обеспечивают рост Т-и В-клеткам. Другая группа гемопоэтических клеток, для которых непосредственным предшественником является более дифференцированная миелоидная стволовая клетка (МСК), включает эритроциты, мегакариоциты и тромбоциты, а также гранулоцитарный и моноцитарно-макрофагальный ростки. Происхождение больших гранулярных лимфоцитов изображено на схеме гипотетично (из М. D. Cooper et al.).
Таблица 62-1. Характеристики иммунных и воспалительных эффекторных клеток человека
| Тип клеток Функциональные поверхно- Клеточные функции, опосредуемые | ||
| стные молекулы | через поверхностные молекулы | |
| Т-лимфоцит | Т3/Т-клеточный рецептор- | Распознавание антигена, актива |
| ный комплекс для анти | ция Т-клеток | |
| Гена | ||
| Рецептор для эритроцитов | Активация Т-клеток | |
| барана (Т11-антиген) | ||
| Т4-антиген | Маркер индукторно-хелперных | |
| Т-клеток и субпопуляции цито- | ||
| токсических Т-клеток. Т4-моле- | ||
| кула облегчает распознавание | ||
| антигена Т4-клетками и явля | ||
| ется поверхностной распозна | ||
| вательной молекулой, через ко | ||
| торую вирус HTLV III/LAV | ||
| (СПИД) инфицирует эту суб | ||
| популяцию | ||
| Т8-антиген | Маркер супрессорных и цито- | |
| токсических клеток. Т8-моле- | ||
| кула облегчает распознавание | ||
| антигена Т8-клетками через | ||
| молекулы ГКСГ класса I | ||
| Рецептор для интерлей- | Имеется на активированных Т- | |
| В-лимфоцит | кина-2 (ИЛ-2) Поверхностные иммуно- | клетках, присоединяет ИЛ-2 Распознавание антигена, клеточ |
| глобулины (sig) | ная активация | |
| Fc-рецепторы для IgG | Присоединяют иммунные комп | |
| лексы | ||
| СЗ-рецепторы | Присоединяют иммунные комп | |
| лексы | ||
| Большой грану | Fc-рецепторы для IgG | Присоединяют иммунные комп |
| лярный лим | лексы | |
| фоцит (БГЛ) | ||
| Моноцит/мак | Fc-рецепторы для IgG | Присоединяют и фагоцитируют |
| рофаг | иммунные комплексы | |
| СЗ-рецепторы | Присоединяют и фагоцитируют | |
| иммунные комплексы | ||
| Антигены ГКСГ класса II | Представление антигена Т- и В- | |
| (1а) | клеткам | |
| Хемотаксические рецеп | Поляризация и хемотаксис кле | |
| Торы | ток | |
| Нейтрофил | Fc-рецепторы для IgG | Присоединяют и фагоцитируют |
| иммунные комплексы | ||
| Хемотаксические рецеп | Поляризация и хемотаксис кле | |
| Торы | ток | |
| СЗ-рецепторы | Присоединяют и фагоцитируют | |
| иммунные комплексы | ||
| Эозинофил | Fc-рецепторы для IgG | Присоединяют иммунные комп |
| лексы | ||
| СЗ-рецепторы | Присоединяют иммунные комп | |
| лексы | ||
| Базофил,тучная клетка | Fc-рецепторы для IgE СЗ-рецепторы | Опустошение гранул, содержащих медиаторы немедленной |
| гиперчувствительности после | ||
| перекрестного связывания при | ||
| крепленного к Fc-рецепторам | ||
| IgE с аллергеном (антигеном) |

Рис. 62-2. Модель внутритимусного созревания Т-клеток у человека. Незрелые Т-клетки в субкапсулярной коре (стадия I) и внутренней коре (стадия II) дают рост зрелым Т-клеткам в небольших участках тимусной внутренней коры и мозгового вещества (стадия III). Тимоциты на стадии III мигрируют на периферию (периферическая кровь, лимфатические узлы, селезенка) и после встречи с антигеном превращаются в популяции Т-эффекторных клеток памяти.
Т-клетки. Т-лимфоциты происходят из костномозговых клеток-предшественников, которые в течение эмбрионального развития и в ранний постнатальный период мигрируют в тимус. Т-лимфоциты отличаются от других типов эффекторных клеток иммунной системы тем, что пул эффекторных Т-клеток формируется в тимусе на ранних этапах эмбриогенеза и поддерживается в течение всей жизни путем антиген-индуцируемой экспансии длительно живущих Т-клеток, которые главным образом локализуются в периферических лимфоидных органах и рециркулируют в кровь и лимфу. Зрелые Т-лимфоциты составляют 70—80% от числа всех лимфоцитов в периферической крови, 90% — в лимфе грудного протока, 30—40% — в лимфатических узлах и 20—30% — в селезенке. В лимфатических узлах Т-лимфоциты располагаются глубоко в паракортикальных зонах вокруг В-клеточных герминативных центров, а в селезенке — в периартериолярных зонах белой пульпы (см. гл. 55). Т-клетки являются основными эффекторами клеточно-опосредованного иммунитета. Немаловажную роль в этом играет также субпопуляция Т-клеток, созревающих в цитотоксические клетки, способные лизировать вирус-инфицированные или чужеродные клетки. Т-клетки также являются и главными регуляторными клетками функций Т- и В-лимфоцитов и моноцитов, что происходит вследствие продукции лимфокинов и прямого клеточного контакта; кроме того, Т-клеткн оказывают регулирующее действие на созревание эритроидных клеток в костном мозге. На клеточной поверхности человеческих Т-клеток находятся белки, служащие маркерами отдельных стадий внутритимического созревания Т-клеток; многие из этих молекул опосредуют или усиливают их специфические функции (см. табл. 62-1). К самым ранним типам клеток Т-ряда относят протимоциты, располагающиеся в субкапсулярной кортикальной зоне тимуса (рис. 62-2), многие из которых экспрессируют белок, обладающий способностью присоединять эритроциты барана (Т11)[1] и панспецифический (т. е. характерный для всех клеток Т-ряда) белок 3А1-р40 (стадия I). По мере своего созревания протимоциты продвигаются во внутреннюю кору тимуса, приобретают кортикальный тимоцитарный белок Т6 и коэкспрессируют молекулы Т4 и Т8 (стадия II). Более чем 90% тимоцитов, находящихся в коре на стадии II, погибает внутри тимуса, и только небольшая часть тимоцитов достигает фенотипической и функциональной зрелости. Созревшие Т-клетки, локализующиеся небольшими группами во внутренней коре, при продвижении через мозговое вещество тимуса начинают экспрессировать ассоциированные с Т-клеточным антигеноспецифическим рецептором молекулы Т3, которые, как полагают, имеют важное значение в селективном расселении (хоминг-эффект) Т-лимфоцитов в периферические лимфоидные органы (стадия III). На этой же стадии на клетках появляются с высокой плотностью антигены HLA-A, -В и -С. В процессе созревания Т-клетки теряют Т6-антиген и реципрокно экспрессируют Т-клеточно-субпопуляционные антигены Т4 и Т8. Зрелые T4+-клeтки индуцируют дифференцировку В-клеток, вызывают пролиферацию Т8+-цитотоксических Т-клеток, продуцируют различные лимфокины и регулируют определенные стадии эритропоэза. Субпопуляция T4+-клeтoк может также функционировать в качестве цитотоксических эффекторных клеток и распознавать чужеродный антиген в контексте с антигенами главного комплекса гистосовместимости (ГКГС) класса II (Ia-антигены). Т8+-клетки функционируют в качестве супрессоров В-клеточного синтеза антител и в качестве эффекторных Т-клеток, которые распознают чужеродный антиген, ассоциированный с антигенами ГКГС класса I (см. гл. 63).
Стадии I, II и III созревания Т-клеток являются клинически значимыми с той точки зрения, что Т-клеточные злокачественные нарушения можно сгруппировать, основываясь на характеристиках одной из этих стадий. При Т-клеточных острых лимфобластозных лейкозах и лимфомах на клетках обнаруживаются сходные фенотипические маркеры, имеющиеся на стадиях I и II, вследствие чего эти злокачественные расстройства относятся к опухолям незрелых Т-клеток. Некоторые формы кожных Т-клеточных лимфом (грибовидный лейкоз, синдром Сезари) и синдром Т-клеточного лейкоза взрослых (ассоциированный с HTLV-1-инфекцией) представляют собой преимущественную пролиферацию Т-клеток с фенотипом, характерным для стадии III, и поэтому являются злокачественным поражением зрелых Т-клеток.
Структурные основы ассоциации функциональной компетентности Т-клеток и поверхностной экспрессии Т3-антигена заключаются в том, что два из Т3-белков присоединяются к Т-клеточному рецептору для антигена. Т-клеточный рецептор для антигена, называемый Тi, является гетеродимером (мол. масса 90000), состоящим из одной a-цепи с мол. массой 50000 и одной b-цепи с мол. массой 43 000.
Следует отметить, что a- и b-молекулы Т-клеточного рецептора для антигена имеют гомологичные аминокислотные последовательности и структурные сходства с тяжелыми и легкими цепями иммуноглобулинов. Тi-цепь содержит четыре отдельно кодируемых области: V (вариабельная), D (обеспечивающая разнообразие), J (соединяющая) и С (константная), а Тi-a-цепь состоит по крайней мере из V-, J- и С-областей. Таким образом, Т-клеточный рецептор для антигена имеет константную и вариабельную области, а гены для a- и b-цепей Т-клеточного рецептора подвергаются перегруппировкам на ранних стадиях созревания Т-клеток, что заканчивается синтезом полностью собранной Тi-молекулы.
Распределение эпителиального компонента тимуса в зонах соответствует различным субпопуляциям тимоцитов (см. рис. 62-2). Тимусные эпителиальные клетки, содержащие тимусные гормоны тимопоэтин, тимулин и a1-тимозин, локализуются главным образом в субкапсулярно-кортикальной и медуллярной зонах тимуса.
Считается, что гормоны тимуса играют важную роль на первых стадиях созревания Т-клеток. Специфичность зрелых Т-клеток в большой степени определяется уже на уровне тимуса. Например, внутритимическнм путем происходит элиминация Т-клеток, способных реагировать с аутологичными (собственными) антигенами, в результате чего предотвращается развитие аутоиммунной реактивности. По-видимому, и для позитивной селекции также характерны внутритимусные процессы. Т-клетки распознают чужеродные антигены в ассоциации с поверхностноклеточными молекулами, кодируемыми генами главного комплекса гистосовместимости (ГКГС), при взаимодействии с антигенпредставляющими клетками. Так, цитотоксические Т8+ Т-клетки распознают антигены в комбинации с ГКГС-молекулами класса I ((HLA-B, -В и -С), тогда как хелперные Т4+ и цитотоксические T4+ T-клeтки распознают и отвечают на чужеродные антигены в контексте ГКГС-молекул класса II (la-подобные). Тот факт, что процессу распознавания способствует ассоциация поверхностных фенотипических маркеров Т-клеток с молекулами ГКГС, позволяет предположить, что сами по себе антигены Т4 и Т8 способствуют этому процессу или по крайней мере присоединению Т-клеток к чужеродному антигену. Эта способность к двойному распознаванию чужеродной антигенной детерминанты в комплексе с аутодетерминантами ГКГС класса I или II на моноцитах/макрофагах получила название ГКГС-рестри к-ц и и иммуноклеточных взаимодействий.
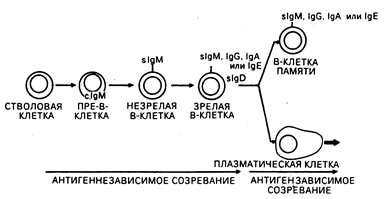
Рис. 62-3. Модель дифференцировки В-клеток. В-клетки претерпевают антигеннезависимые и антигензависимые стадии созревания, которые заканчиваются терминальной дифференцировкой либо в антителосекрсти-рующие плазматические клетки, либо в В-клетки памяти.
В-клетки. У человека зрелые В-клетки составляют 10—15% от числа лимфоцитов в периферической крови, 50% — в селезенке и приблизительно 10% — в костном мозге. На своей поверхности они экспрессируют внутримембранные молекулы иммуноглобулинов, которые функционируют в качестве В-клеточных рецепторов для антигена. На В-клетках также обнаруживается экспрессия поверхностных рецепторов для Fc-фрагментов IgG-молекул и, кроме этого, рецепторов для активированных компонентов комплемента (C3d, C3b). Основной функцией В-клеток является продукция антител. Зрелые В-клетки ведут свое происхождение из костномозговых клеток-предшественников, продукция которых постоянно поддерживается в течение всей жизни (см. рис. 62-1; рис. 62-3). Как миелоидные и эритроидные клетки, В-клетки постоянно замещаются посредством клеточных делений костномозговых предшественников. Однако созревание В-лим-фоцитов отличается от клеток миелоидного и эритроидного ряда тем, что В-лим-фоциты проходят в своем развитии антигензависимую и антигеннезависимую стадии созревания (см. рис. 62-3). Пре-В-клетки происходят из клеток-предшественников костного мозга и могут быть выявлены по наличию в цитоплазме иммуноглобулина М (cIgM) (точнее, сначала обнаруживаются тяжелые цепи IgM с последующим синтезом цитоплазматических легких цепей). Незрелые В-клетки мигрируют на периферию и продолжают свое антигеннезависимое созревание, экспрессируя поверхностный IgD, приобретая В-клеточные свойства для антигенов и переключая В-клеточный изотип поверхностных иммуноглобулинов таким образом, что на поверхности остается только один из них (IgM, IgG, IgA или IgE) в сочетании с IgD. Благодаря наличию по одной вариабельной области у тяжелой и легкой цепи иммуноглобулина каждой В-клеткой экспрессируется только одна антигенная специфичность. Установлено, что в лимфоидных органах В-клетки преобладают в кортикальных герминативных центрах и медуллярных шнурах лимфатических узлов, а также в первичных и вторичных герминативных центрах белой пульпы селезенки (см. гл. 55). При контакте с антигеном зрелые В-клетки в периферических лимфатических узлах и селезенке подвергаются либо конечной дифференцировке в антителосекретирующие плазматические клетки, либо пролиферации с образованием популяций долгоживущих В-клеток памяти, способных при повторной встрече с тем же самым антигеном вступать с ним во взаимодействие (см. рис. 62-3).
Большие гранулярные лимфоциты. Большие гранулярные лимфоциты (БГЛ) составляют 5—10% от числа лимфоцитов периферической крови; это неприлипающие, нефагоцитирующие клетки с большими азурофильными гранулами в цитоплазме. БГЛ экспрессируют поверхностные рецепторы для Fc-фрагмента IgG (см. табл. 62-1), многие БГЛ экспрессируют маркеры, характерные для Т-клеток, и пролиферируют в ответ на интерлейкин-2 (фактор роста Т-клеток). У БГЛ имеется ряд общих функциональных признаков как с моноцитами/ макрофагами, так и с нейтрофиламн. Так, некоторые субпопуляции БГЛ опосредуют антителозависимую клеточную цитотоксичность (АЗКЦ) и активность естественных киллерных клеток. Активность естественных киллерных клеток (ЕКК) — это неиммунное (т. е. эффекторные клетки никогда до этого не вступали в контакт с клетками-мишенями), не опосредованное антителами уничтожение мишеневых клеток, как правило, имеющих опухолевую природу. Таким образом, БГЛ, которые опосредуют естественную киллерную активность, играют важную роль в иммунном надзоре и деструкции клеток, подвергающихся спонтанной злокачественной трансформации in vivo.
Моноциты/макрофаги. Моноциты происходят из клеток, находящихся в костном мозге (см. рис. 62-1), и циркулируют в крови с периодом полужизни от 1 до 3 дней. Моноциты покидают циркуляторное русло, отграничиваясь в капиллярах и затем мигрируя в широко представленный экстраваскулярный бассейн. Предшественниками тканевых макрофагов служат мигрировавшие из циркуляции моноциты; также они могут образовываться в результате пролиферации макрофагальных предшественников в тканях. Локализуются тканевые макрофаги (а некоторые из них имеют специальное название) чаще всего в лимфатических узлах, селезенке, костном мозге, периваскулярной соединительной ткани, серозных полостях (брюшной, плевральной, синовиальной), соединительной ткани кожи, легких (альвеолярные макрофаги), печени (купферовские клетки), кости (остеокласты). Одним из мест их локализации является центральная нервная система (микроглия).
Основное значение моноцитарно-макрофагальной системы состоит в экспрессии иммунореактивности путем опосредования таких функций, как представление антигена лимфоцитам и секреция таких факторов, как интерлейкин-1 (ИЛ-1), которые играют ключевую роль в активации Т-лимфоцитов. При определенных обстоятельствах моноциты могут также опосредовать иммунорегуляторные функции, в частности, супрессорную клеточную активность. Кроме этого, моноциты/макрофаги опосредуют такие эффекторные функции, как деструкция сенсибилизированных антителами бактерий, опухолевых клеток и даже нормальных гемопоэтических клеток при определенных типах аутоиммунных цитопений. Активированные макрофаги способны проявлять ЕКК-подобную активность и элиминировать некоторые типы опухолевых клеток в отсутствие антител. На моноцитах/макрофагах экспрессируются поверхностные рецепторы для ряда молекул, включая Fc-фрагмент IgG, активированные компоненты комплемента и различные лимфокины (факторы, ингибирующие и активирующие макрофаги; см. табл. 62-1). Помимо этого, на поверхности моноцитов/макрофагов обнаруживаются антигены ГКГС класса II (la-подобные) и специфические клеточные дифференцировочные антигены. И наконец, макрофагальные секреторные продукты намного разнообразнее чем те, которые известны для любого другого типа клеток иммунной системы. За счет этих секреторных продуктов макрофаги обладают как про-, так и антивоспалительным действием, а также оказывают регуляторные воздействия на другие типы клеток. Среди продуктов, секретируемых моноцитами/макрофагами, следует упомянуть гидролитические ферменты, продукты оксидативного метаболизма и ИЛ-1, называемый также лейкоцитарным нирогеном и лимфоцитактивирующим фактором, действие которого распространяется на лимфоциты, гепатоциты, фибробласты, синовиоциты и клетки гипоталамуса.
Нейтрофилы, эозинофилы и базофилы. Гранулоциты — неотъемлемая часть почти всех форм воспаления и представляют собой неспецифический амплификапионный и эффекторный компонент специфического ответа. Неконтролируемое накопление и активация нейтрофилов могут приводить к повреждениям тканей в организме, что наблюдается при нейтрофил- или эозинофилопосредованном некротизирующем васкулите. Предшественниками гранулоцитов являются стволовые клетки костного мозга (см. рис. 62-1). Каждый тип гранулоцитов (нейтрофил, эозинофил, базофил) происходит из различных субклассов клеток-прародителей, которые стимулируются к пролиферации белками, тройными по отношению к каждому клеточному типу. На конечных стадиях созревания гранулоцитов появляются характерная для клеток каждого типа специфическая морфология ядра и гранулы в цитоплазме, что позволяет различать формы гранулоцитов гистологически. Нейтрофилы эксирессируют Fc-рецепторы для IgG и активированных компонентов комплемента (C3d, C3b) (см. табл. 62-1). При взаимодействии нейтрофилов с иммунными комплексами происходит опустошение азуро(рильных гранул (содержащих миелопероксидазу, лизоцим, эластазу и другие ферменты) и специфических гранул (содержащих лактоферрин, лизоцим, коллагеназу и другие ферменты), а на поверхности нейтрофилов возникает генерация бактерицидных супероксидных радикалов (02 ). Считается, что генерация супероксидов приводит к воспалению в результате прямого повреждающего действия на клетки и ткани и изменений макромолекулярных структур, в первую очередь коллагена и ДНК.
Эозинофилы экспрессируют Fc-рецепторы для IgE и представляют собой мощные цитотоксические эффекторные клетки для различных мишеней паразитарной природы. Содержащиеся в цитоплазме эозинофилов такие молекулы, как основной белок, эозинофильный катионный белок и происходящий из эозинофилов нейротоксин, служат причиной прямых повреждений тканей и отчасти органосистемных дисфункций при синдромах гиперэозинофилии (см. гл. 56). Благодаря локализованным в гранулах противовоспалительным ферментам (гистаминаза, арилсульфатаза, фосфолипаза D) эозинофилы могут уменьшать или прерывать начинающееся воспаление при нормальном гомеостазе.
Значение базофилов в норме неизвестно; способность базофильных медиаторов увеличивать локальную доступность антител и комплемента за счет повышения проницаемости сосудов является гипотетичной. Таким образом, функции базофилов связывают главным образом с аллергическими реакциями и с некоторыми состояниями кожной гиперчувствительности замедленного типа. Вместе с тем несомненно, что обеспечиваемая базофилами повышенная проницаемость сосудов представляется важной в генезе воспалительных повреждений в случае некоторых васкулитных синдромов (см. гл. 269). На базофилах экспрессируются поверхностные рецепторы для IgE и при перекрестном связывании присоединенного к базофилам IgE с антигеном начинается опустошение базофильных гранул, содержащих гистамин. эозинофильный хемотаксический фактор анафилаксии, гепарин, тромбоцитактивирующий фактор и медленно реагирующую субстанцию анафилаксии — все медиаторы гиперчувствительности немедленного типа (анафилаксии) (табл. 62-2). Кроме того, у базофилов имеются поверхностные рецепторы для активированных компонентов комплемента (С3а, С5а).
Гуморальные медиаторы иммунитета — иммуноглобулины. Иммуноглобулины—это продукты дифференцированных В-клеток, осуществляющие гуморальное звено иммунного ответа. Их первостепенные функции состоят в присоединении к антигену (токсину, микробу, паразиту или другому чужеродному веществу) и инактивации или удалении его из организма. Структурные основы функций молекул иммуноглобулинов и организации иммуноглобулиновых генов дали возможность по-новому взглянуть на роль антител в нормальном протективном иммунитете, при опосредовании иммунозависимых повреждений иммунными комплексами и образовании аутоантител против детерминант хозяина.
Базисная структура всех нммуноглобулинов включает две тяжелые и две легкие цепи (рис. 62-4). Изотип иммуноглобулинов определяется типом имеющихся тяжелых и легких цепей. IgG и IgA подразделяются на субклассы (IgGI, IgG2, lgG3 и IgG4; IgAl и IgA2), что основано на существовании специфических антигенных детерминант в тяжелых цепях. Характеристики иммуноглобулинов человека в общем виде приведены в табл. 62-3. Четыре цепи соединены между собой ковалентными дисульфидными связями. Каждая цепь включает в себя вариабельную (V) и константную (С) области (также называемые доменами), состоящие из гомологичных единиц длиной в 110 аминокислот. У легких цепей имеется одна вариабельная (VL) и одна константная (CL) области; у тяжелых же цепей — одна вариабельная область (VH) и три или четыре константные области (СН), что зависит от изотипа иммуноглобулина. Как следует из названия, константные области построены из гомологичных последовательностей и имеют одну и ту же общую структуру для всех цепей одного и того же изотипа и субкласса. Константные области вовлечены в осуществление молекулами иммуноглобулинов их биологических функций. СН2-домен IgG и СН4-домен IgM принимают участие в фиксации компонентов комплемента, СН-область карбоксильного конца молекулы IgG, Fc-фрагмент (см. рис. 62-4), присоединяется к поверхностным Fc-рецепторам макрофагов, БГЛ, В-клеток, нейтрофилов и эозинофилов.
Таблица 62-2. Медиаторы, освобождаемые из тучных клеток и базофилов
| Медиатор | Действия |
| Гистамин | Сокращения гладких мышц, повышенная проницаемость сосудов |
| Медленно реагирующая субстанция анафилаксии (SRSA) лейкотриен D4 | Сокращения гладких мышц |
| Эозинофильный хемотаксический фактор анафилаксии (ECF-A) | Хемоаттракция эозинофилов |
| Тромбоцитактивирующий фактор | Активация тромбоцитов к секреции серотонина и других медиаторов |
| Нейтрофильный хемотаксический фактор (NCF) | Хемоаттракция нейтрофилов |
| Лейкотаксическая активность (лейкотриен В4) | Хемоаттракция нейтрофилов |
| Гепарин | Антикоагулянт |
| Базофильный калликреин анафилаксии (ВК-А) | Расщепление кининогена для образования брадикинина |
Таблица 62-3. Характеристики иммуноглобулинов человека
| Изотоп | Молекулярная масса | Тяжелая цепь | Легкая цепь | Средний уровень в сыворотке у взрослых. (мг/дл) | Период полужизни (дни) | Активация комплемента | Присоединение к клеткам через Fc-фрагмент | Другие биологические свойства | |
| классический путь | альтернативный путь | ||||||||
| IgG | g1, g2, g3, g4 | К или g | 1 250±300 | 23,0 | IgGI, IgG2, IgG3 —да; lgG4 — нет | IgGI, IgG2, IgG3 — да; lgG4 — нет | Макрофаги, нейтрофилы, эозинофилы, большие гранулярные лимфоциты | Переход через плаценту | |
| IgM | 190000 (950000)' | m | К или l | 125±50 | 5,1 | Да | Нет | Лимфоциты | Первичный иммунный ответ, ревматоидный фактор |
| IgA | 160000 (385 000)2 | a1 , a2 | К или l | 210±50 | 5,8 | Нет | Да | Лимфоциты | Антитела в секретах слизистых оболочек |
| IgD | d | К или l | 2,8 | Нет | Да | Не имеется | Первичная поверхностная молекула лимфоцитов | ||
| IgE | e | К или l | 0,03 | 2,5 | Нет | Да | Тучные клетки, базофилы | Опосредует анафилаксию, аллергию |
' IgM находится в циркуляции в виде пентамерной молекулы. 2 Секреторный IgA является димером.
Из: D. J. Jeske, J. D. Capra. Immunoglobulin: Structure and Function. — In: Fiindumental

Рис. 62-4. Схематическая структура молекулы иммуноглобулина G (IgG)
Антителосвязывающая область (Fab) молекулы представлена вариабельными областями (VL и VH) с расположенными в них гипервариабельнымн участками с чрезмерно высоким разнообразием последовательностей, благодаря чему антигенсвязывающий участок является уникальным для каждой иммуноглобулиновой молекулы. Идиотип—это специфический регион Fab—часть молекулы иммуноглобулина, к которому происходит присоединение антигена. Антитела против идиопатического участка антительной молекулы называются антиидиотипическими. При образований антиидиотипических антител in vivo в течение развития нормального В-клеточного иммунного ответа может генерироваться отрицательный (или «выключающий») сигнал, заставляющий В-клетки прекращать их продукцию (см. ниже).
IgG составляют около 75% всех иммуноглобулинов сыворотки. Четыре IgG-субкласса нумеруются в зависимости от их содержания в сыворотке: IgG1 обнаруживается в наибольших количествах, a IgG4 — в наименьших. Клиническая значимость разных субклассов IgG состоит в их различной способности присоединяться к макрофагальным и нейтрофильным рецепторам и активировать комплемент (табл. 62-3). Как правило, IgG-антитела вырабатываются после повторной встречи организма с антигеном (вторичный иммунный ответ). Из всех изотипов иммуноглобулинов только IgG способен проходить через плаценту. В нормальных условиях IgM находится в циркуляции в виде центамера (мол. масса 950000), состоящего из мономеров с мол. массой 160000, соединенных между собой так называемыми j-цепями, неиммуноглобулиновыми молекулами с мол. массой 15000, которые также оказывают воздействие на полимеризацию молекул IgA. IgM — это первый иммуноглобулин, появляющийся при иммунном ответе (первичный антительный ответ), и является первоначальным типом антител, вырабатываемых новорожденными. Мембранный IgM в мономерной форме также функционирует в виде главного рецептора для антигена на поверхности зрелой В-клетки. IgM — важный компонент иммунных комплексов при аутоиммунных заболеваниях. Например, IgM-антитела против IgG-молекул (ревматоидные факторы) выявляются в высоких титрах при ревматоидном артрите, других коллагеновых заболеваниях и некоторых инфекционных болезнях (подострый бактериальный эндокардит). IgM-антитела присоединяют С 1-компонент комплемента через СН4-домен и, таким образом, представляют мощный активатор комплемента. IgA составляют только 10—15% от общего содержания сывороточных иммуноглобулинов, однако это преобладающий класс иммуноглобулинов в секретах экзокринных желез (слезы, слюна, носовые секреты, жидкость желудочно-кишечного тракта и женское молоко). Там он находится в виде секреторного IgA (sIgA), полимера, состоящего из двух IgA-мономеров, соединенных J-цепью, и гликопротеина, обозначаемого как секреторный компонент.
В сыворотке из двух IgA-субклассов (IgAl и IgA2) обнаруживается в основном IgAl, а для секретов характерно преобладание IgA2. IgA фиксирует комплемент через альтернативный путь и у человека обладает выраженной противовирусной активностью, препятствуя прикреплению вируса к эпителиальным клеткам дыхательного и желудочно-кишечного трактов. IgD обнаруживается в сыворотке в следовых количествах (см. табл. 62-3) и наряду с IgM является главным рецептором для антигена на поверхности В-клеток. Имеющийся в сыворотке в очень низких концентрациях (см. табл. 62-3) IgE представляется основным классом иммуноглобулинов, который способствует армированию тучных клеток и базофилов путем присоединения к этим клеткам через IgE-Fc-область. Вызываемое антигеном перекрестное связывание IgE-молекул на поверхности базофилов и тучных клеток приводит к освобождению медиаторов реакций немедленной гиперчувствительности (табл. 62-2).
Так же как гены для Т-клеточного антигенспецифического рецептора, тяжелые и легкие цепи иммуноглобулинов кодируются многими генетическими элементами, которые удалены друг от друга в зародышевой ДНК, но собираются вместе для создания единичного активного гена в В-клетках.
Построение вариабельных областей легких цепей (например, легких цепей типа ) осуществляется за счет двух генов, называемых V и J. Эти гены, хотя и расположены на одной хромосоме, в зародышевом состоянии находятся на значительном удалении друг от друга, однако в процессе созревания В-лимфоцитов способны объединяться посредством вырезания мешающих последовательностей ДНК (перегруппировка генов). Существует примерно 300 V-генов и 5 J-генов, благодаря чему в результате их объединения образуется 1500 различных комбинаций легких цепей. Количество генерированных легких цепей типа значительно возрастает при соматических мутациях, происходящих внутри V- и J-генов, что создает условия для образования огромного числа специфичностей из ограниченного набора зародышевой генетической информации.
Более сложной по сравнению с легкими цепями является перегруппировка генов тяжелых цепей. Как известно, создание VН-домена происходит в результате соединения трех типов зародышевых генов — VН, dh и jh. Как следствие этого достигается значительно большее разнообразие в вариабельной области тяжелых цепей.
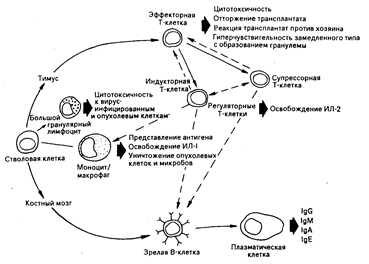
Рис. 62-5. Схематическое изображение клеточных взаимодействий, вовлеченных в генерацию клеточно-опосредованного и гуморального иммунитета [из W. N. Ке1ly et at. (Eds.)].
Дата добавления: 2015-03-17; просмотров: 820;
