Лекція №29
Навчальні питання:
1. Загальні відомості про сплави.
2. Діаграма стану подвійних сплавів.
Навчальне питання 1. Загальні відомості про сплави.
Металевими сплавами називають сполуки, які добувають сплавлянням (іноді спіканням) металів з металами або неметалами. У сплавів зберігаються високі тепло і електропровідність, ковкість і інші металеві властивості. Будова сплавів складніша за будову чистих металів, тому властивості сплавів значно відрізняються від властивостей чистих металів. Наприклад, залізо має границю міцності близько 250 Мн/м3 (25 кГ/мм2), а сплави на його основі — до 2000 Мн/м2 (200 кГ/мм2) і вище. Залізо і нікель — метали феромагнітні, а сплав заліза з 25% Ni не має цієї властивості. Сплав, який складається з 50% Ві, 25% Рb, 12,5% Sn і 12,5% Сd, плавиться при температурі 68°С, тоді як найбільш легкоплавкий з його компонентів (Sn) має температуру плавлення 231,9°С. Усі ці приклади не тільки виявляють можливість зміни властивостей металів при сплавлянні їх з іншими елементами, а й свідчать про потребу всебічного вивчення сплавів для раціонального використання їх у різних галузях сучасної техніки.
Фази І структурні складові в сплавах. У рідкому стані більшість сплавів однорідна і у фізико-хімічному розумінні є однією фазою. Після затвердіння в сплаві може сформуватися кілька фаз.
Якщо компоненти сплаву при твердінні розчиняються один в одному, то утворюються так звані тверді розчини. При цьому атоми розчинного компонента або заміщують атоми розчинника в його кристалічній решітці, або проникають у неї.
Заміщення одних атомів іншими в кристалічній решітці може бути необмеженим і обмеженим. Необмежене заміщення (необмежена розчинність) можливе, якщо в компонентів сплаву однакові кристалічні решітки і невелика відмінність у розмірах атомів (до 15%), інакше заміщення атомів спричинить надмірне викривлення кристалічної решітки розчинника і в певний момент дальша розчинність виявиться неможливою — настане границя розчинності. Для різних комбінацій металів ця границя змінюється від часток до десятків процентів. Наприклад, цинк у магнію розчиняється до 1,4, а в міді — до 39%; мідь і нікель, золото і срібло та деякі інші метали мають необмежену розчинність один в одному.
Тверді розчини проникнення утворюються звичайно при взаємодії металів і неметалів (наприклад, розчин вуглецю в залізі).
Якщо при твердінні компоненти сплаву не взаємодіють один з одним, то утворюється механічна суміш зерен кожного з компонентів. Наприклад, сплав свинцю з сурмою після твердіння являє собою суміш двох фаз — зерен свинцю і сурми. Механічна суміш деяких сплавів може складатись і з більшої кількості різних фаз; звичайно, кожна з них зберігає свій тип кристалічної решітки.
Ряд компонентів при твердінні можуть вступати в хімічну взаємодію і утворювати хімічні сполуки як металів з неметалами, так і тільки металів.
Хімічні сполуки металів з неметалами (оксиди, сульфіди та ін.) мають особливий тип кристалічної решітки, цілком певний склад, а також характерні фізико-механічні властивості (високу твердість, підвищену крихкість). У сплавах вони звичайно перебувають у вигляді включень.
Сполуки металів з металами характеризуються змінним складом. Наприклад, у сполуці FeCr вміст хрому може змінюватись від 20 до 60%. Недодержання закону постійності складу істотно відрізняє їх від звичайних хімічних сполук. Тому їх Іноді називають не хімічними, а металевими сполуками.
Отже, фазами в сплавах бувають тверді розчини, чисті компоненти, хімічні і металеві сполуки. Комбінації цих фаз можуть утворювати різні структурні складові сплаву, які спостерігаються під мікроскопом як однотипні. Структурні складові, а отже і сплави, можна поділити на одно і багатофазні.
Навчальне питання 2. Діаграма стану подвійних сплавів.

Залежність агрегатного або фазового стану сплавів від їх складу і температури встановлюють експериментально за допомогою термічного аналізу — визначення критичних точок перетворень за кривими нагрівання (охолодження). У ряді випадків для визначення критичних точок поряд з термічним аналізом застосовують інші методи дослідження (металографічний; рентгеноструктурний та ін.). За дослідними даними будують так звані діаграми стану, які відображають зв’язок між станом сплавів, їх складом і температурою, а також фазові перетворення, що відбуваються в сплавах при нагріванні й охолодженні. .
Діаграма стану при повній взаємній розчинності компонентів. За цією діаграмою затвердівають сплави, компоненти яких необмежено розчиняються один в одному. Порядок побудови і саму діаграму стану такого типу розглянемо на прикладі сплавів, компонентами яких є метали А і В (рис. 7).
На рис. 7, а наведено криві охолодження чистих металів А і В, а також сплавів І (70%А +30%В) і II (20%А + 80%В). Чисті метали, як бачимо, мають по одній, а сплави—по дві критичні точки. Вище точок 1, 2, 4, 6 чисті метали і їх сплави перебувають у рідкому, а нижче точок 1, 3, 5, 6-у твердому стані. Отже, сплави 1 і II, на відміну від їх компонентів — чистих металів А і В, затвердівають не при сталій температурі, а з інтервалі температур відповідно між точками 2—З і 4—5.
Діаграму стану подвійних сплавів будують у двох вимірах ,(рис. 7, 6): по вертикальній осі відкладають температуру, а по горизонтальній осі, яку називають віссю концентрацій,— склад сплавів. При цьому зліва направо кількість компонента А в сплаві зменшується від 100 до 0%, а компонента В збільшується від 0 до 100%. Отже, крайній лівій ординаті відповідає чистий компонент А, крайній правій — компонент В, а проміжній між ними точці (ординаті) — певного складу сплав. При побудові діаграми саме в цих точках ставлять вертикалі для кожного з досліджуваних сплавів (у розглядуваному випадку — І і ІІ). Підготувавши таке поле для побудови діаграми, на вертикалі переносять відповідні експериментальні критичні точки з кривих охолодження.
Сполучивши точки аналогічних перетворень, дістають лінії, що розмежовують зони однакових фаз. Ці зони в сукупності і являють собою діаграму стану досліджуваних сплавів. У розглядуваному випадку точки аналогічних перетворень — це точки початку (2'4') і закінчення (3', 5') твердіння сплавів. Чисті компоненти А і В затвердівають при сталій температурі, тому початок і кінець твердіння в них відображається однією критичною точкою (відповідно 1' і 6').
Лінію, що сполучає точки твердіння сплавів, називають ЛІНІЄЮ ліквідує(від латинського liquidus—рідкий), а лінію, яка Сполучає точки закінчення твердіння сплавів, — лінією солідус (solidus—твердий). Між цими лініями сплави складаються з двох фаз — твердої і рідкої.
Сплав І починає затвердівати в точці 2', виділяючи кристали твердого розчину (позначимо його α) компонента В в А. При дальшому охолодженні кристали а-розчину ростуть за рахунок рідкої фази. У точці 3' на лінії солідус твердіння сплату закінчується, після чого він має однофазну структуру, що Складається з зерен твердого розчину. При нагріванні цей сплав Зазнає перетворень у зворотній послідовності. Сплав II у точках 4' і 5' зазнає аналогічних перетворень.
Відповідно до діаграми стану розглянутого типу кристалізуються сплави заліза з нікелем, міді з золотом, сурми з вісмутом та ін.
Діаграма стану при нерозчинності компонентів (рис. 8).
Лінія ліквідує на такій діаграмі — це лінія АСВ, а солідус— DCF..
Розгляд процесів твердіння і структур сплавів цієї системи краще почати із сплаву II, що має одну критичну точку С. Цей сплав затвердівае при сталій температурі, утворюючи кристали обох компонентів. Тому після твердіння структура сплаву — це суміш дрібних зерен компонентів А і В. Вона називається евтектичною сумішшю, або евтектикою (Е).
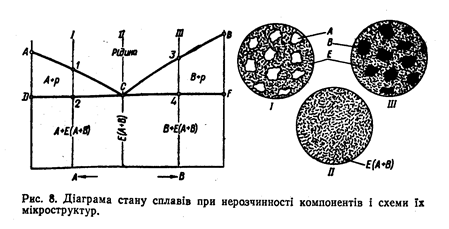
Евтектика утворюється в сплавах при цілком певному співвідношенні компонентів, у нашому випадку — при концентрації, що визначається точкою С. Тому цю точку називають евтектичною, а сплав з евтектичною концентрацією компонентів, а отже, і з евтектичною структурою, — евтектичним сплавом. На відміну від інших сплавів цієї системи, евтектичний сплав затвердіває не в інтервалі температур, а при сталій температурі, до того ж мінімальній. Сплави, розташовані ліворуч від евтектичної точки, називаються доевтектичними, а праворуч — заевтектичними.
Твердіння доевтектичного сплаву І починається на лінії ліквідує у точці 1 випаданням кристалів надлишкового компонента А. Тому в інтервалі між точками 1 і 2 (між лініями ліквідує і солідус) рідкий сплав, що залишився, збіднюється компонентом А і відповідно збагачується компонентом В. При температурі точки 2 сплав складається з кристалів компонента А і рідини евтектичної концентрації, яка затвердівае з утворенням евтектики, тому лінію DCF ще називають лінією евтектичного перетворення. Кристали компонента, що виділилися раніше, не зазнають при цьому ніяких змін.
Отже, доевтектичні сплави після твердіння складаються з двох структурних складових — кристалів компонента А і евтектики Е. Очевидно, що чим ближче до евтектичного буде за своїм складом доевтектичний сплав, тим більше в його структурі буде евтектики.
Процес твердіння заевтектичних сплавів відрізняється від описаного лише тим, що в ньому на лінії ліквідує (точка 3) починають випадати кристали компонента В. Тому після оста-точного твердіння (точка 4) структура цих сплавів складається з кристалів компонента В і евтектики Е.
Відповідно до цієї діаграми стану тверднуть сплави свинцю з сурмою, олова з цинком, вісмута з кадмієм та ін.
Діаграма стану при обмеженій розчинності компонентів [(рис. 9). Випадок повної нерозчинності компонентів, який було розглянуто вище, трапляється порівняно рідко. Звичайно вони частково розчиняються один в одному. Тому на діаграмі стану сплавів з обмеженою розчинністю біля ординати, що відповідає компоненту А, міститься зона α-твердого розчину, який є розчином компонента В в компоненті А. Тут АСВ — лінія ліквідує, АDСF— лінія солідус, DCF — лінія евтектичного перетворення, точка С — евтектична точка.
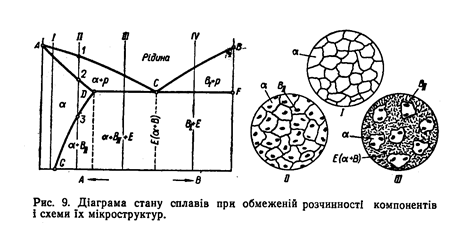
Твердіння сплавів, що лежать ліворуч від точки С, починається з випадання кристалів а-твердого розчину. Тому між лініями ліквідує і солідус ліворуч від точки С сплави складаються з кристалів а-твердого розчину і рідини, а праворуч від неї — з кристалів компонента В і рідини.
Сплави ліворуч від точки D остаточно затвердівають відповідно до лінії АD з утворенням твердого розчину компонента В в компоненті А.
Розчинність компонента В в А визначається лінією GD яку називають лінією граничної розчинності. Сплави, розташовані ліворуч від точки G (наприклад, сплав /), не зазнають ніяких перетворень при охолодженні після твердіння до кімнатної температури і складаються з зерен α-твердого розчину. Кристалізація сплавів, що містяться в зоні змінної розчинності компонентів— між точками G, D (наприклад, сплав //), починається в точці 1 і закінчується в точці 2 утворенням однофазної структури з зерен α-твердого розчину. При температурі, що відповідає точці 3, α-твердий розчин стає пересиченим, тому з нього починає виділятися компонент В, який у таких умовах називають надлишковим і позначають В// на відміну від первинного В/, що виділяється безпосередньо з рідкого сплаву.
Сплави праворуч від точки D затвердівають відповідно до розглянутої діаграми стану для випадку повної нерозчинності компонентів. При цьому компонентами сплавів слід вважати чистий компонент В і α-твердий розчин. Тому структура евтектичного сплаву складатиметься з суміші зерен α-твердого розчину і компонента В, доевтектичного (сплав III) — з зерен а-твердого розчину (з украпленнями надлишкового компонента В//) і евтектики, а заевтектичного (сплав IV) — з зерен компонента В/ і евтектики.
Обмежена розчинність спостерігається в багатьох металів, а також металів і неметалів, тому цей тип діаграми стану дуже поширений. Відповідно до цієї діаграми тверднуть, наприклад, сплави алюмінію з кремнієм, алюмінію з міддю та ін.
Діаграма стану для випадку, коли компоненти утворюють стійку хімічну сполуку. Хімічна сполука в сплавах є самостійним компонентом. Це дає можливість будувати і розглядати діаграму стану сплавів з компонентів А і В в діапазоні концентрацій компонента В не від 0 до 100%, а до концентрації, при якій він утворює з компонентом А хімічну сполуку АпВт, наприклад: у сплавах заліза з вуглецем — сполуки Fе3С при концентрації вуглецю 6,67%.
На закінчення розгляду основних типів діаграм стану сплавів слід зазначити, що на практиці звичайно застосовують сплави, які складаються не тільки з двох, а й з більшого числа компонентів. У цьому випадку для відтворення їх складу на діаграмі використовують не лінію, а площину, у зв’язку з чим такі діаграми мають складніший, просторовий вигляд.
Слід також зауважити, що діаграми стану, відтворюючи залежність структури сплавів від їх концентрації і температури, показують також характер зміни їх властивостей, тобто між діаграмами стану сплавів і їх властивостями існує тісний зв’язок, що набагато підвищує практичну цінність діаграм.
Інформаційні джерела:
1. Технологія конструкційних матеріалів./За ред. А.М. Сологуба. - К.: Вища школа, 1993 –
300 с.
2. Большаков В.І., Береза О.Ю., Харченко В.І. Прикладне матеріалознавство: Підручник. Дніпропетровськ: РВА „Дніпро VAL”.2000 – 290 с.
3. Технология конструкционних материалов. /Г.А. Прейс, М.А. Сологуб, И.А. Рожнецкий/ - К.: Вища школа 1991 – 391 с.
4. Дальский А.М. и др. Технология конструкционных материалов, М.: Машиностроение. 1990 - 351 с.
Дата добавления: 2015-03-14; просмотров: 1043;
