Электрохимическая коррозия металлов. Причины образования коррозионных гальванических пар
Электрохимическое растворение металлов включает в себя две группы процессов: растворение за счет внешнего тока (анодное растворение) и в результате взаимодействия с компонентами среды (коррозия).
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды. В зависимости от характера разрушений различают сплошную коррозию, захватывающую всю поверхность металла, и местную, локализующуюся на определенных участках. Очаги разрушения в случае местной коррозии могут иметь вид пятен (пятнистая коррозия) или точек (питтинговая коррозия). Они могут захватывать зерна только одного из компонентов металлического сплава (избирательная коррозия), проходить через все зерна в виде узких трещин (транскристаллитная коррозия) или сосредоточиваться по границам зерен (интеркристаллитная коррозия).
Скорость и характер коррозии определяются, прежде всего, природой металла и окружающей его среды. Металлы в зависимости от скорости коррозии в данной среде разделяют на устойчивые и неустойчивые. На основе того, с какой скоростью данная среда разрушает металл, ее определяют как агрессивную или неагрессивную в коррозионном отношении. Корродируют, как правило, металлы (черные и цветные), встречающиеся в природе не в самородном состоянии, а как соответствующие минералы и руды.
Различают коррозию химическую и электрохимическую.
Химическая коррозия наблюдается при воздействии на металл различных веществ (жидкостей-неэлектролитов и газов) при высоких температурах. Таково окисление железа в воздухе при высоких температурах с образованием окалины.0
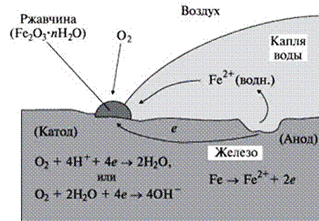
Исключительно большое распространение имеет электрохимическая коррозия, так как часто протекает со значительной скоростью при обычной температуре, когда химическая коррозия почти не проявляется. Электрохимическая коррозия возникает при соприкосновении металла (сплава) с электропроводящей жидкостью (почвенной водой, водой в паровых котлах, различными реакционными средами, главным образом, в химической промышленности) (рис. 8 и 9).
Достаточно присутствия тонкой пленки жидкости на поверхности металла, чтобы электрохимическая коррозия стала возможной. Этот тип коррозии характеризуется возникновением электрических токов между различными участками металла (передвижение электронов), являющихся следствием электрохимических реакций на отдельных участках поверхности соприкосновения металла с электролитом.
| 
|
| Рис. 8 Схема коррозионного разрушения железной пластины под каплей воды | Рис. 9 Схема контактной коррозии |
Растворение металла в кислотах также можно считать электрохимической коррозией.
Так как коррозия сопровождается уводом электронов с поверхности металлов, она может происходить не только под действием разряжающихся ионов гидроксония, а может быть результатом действия любых окислителей, являющихся акцепторами электронов. Например, саморастворение металлов сильно ускоряется в присутствии в растворе кислорода воздуха, так как на поверхности металла протекает реакция
1/2 O2 + 2e + H2O = 2OH-,
причём эта реакция протекает при более положительном потенциале, чем разряд ионов гидроксония.
Для объяснения коррозии Де-ла-Рив в 1830 году выдвинул идею локальных (местных) элементов, возникающих на поверхности металлов, погружённых в жидкость. Например, в случае контакта меди и железа образуется накоротко замкнутый элемент, растворимым полюсом которого является железо, так как электроны переходят от железа к меди. При контакте металлов электроны переходят от более электроотрицательного металла к более электроположительному, вследствие чего первый будет растворяться, а на втором будут разряжаться ионы гидроксония или восстанавливаться растворённый кислород. Это случай так называемой контактной коррозии. Такого типа коррозия может возникать и на одном металле в местах, подвергшихся различной обработке или при наличии различных инородных включений, особенно металлических. В этом случае образуются своеобразные микроэлементы, замкнутые через основной металл, работа которых приводит к усилению обычной коррозии. Реальное существование местных микроэлементов было доказано экспериментально Г.В. Акимовым. Он показал, что разности потенциалов между отдельными частями поверхности обычно равны нескольким милливольтам.
Было установлено, что коррозия возникает самопроизвольно и на однородной поверхности, поэтому нельзя связывать её только с действием локальных или местных элементов. Наличие этих элементов лишь усиливает коррозию.
А.Н. Фрумкин развил электрохимическую теорию коррозии металлов; он показал, что электрохимические реакции, обусловливающие коррозию, могут протекать при одном и том же потенциале на одном и том же участке поверхности металла. Проведённые расчёты потенциала свидетельствуют о весьма малом различии между отдельными участками поверхности металла.
Дата добавления: 2014-12-05; просмотров: 3161;
