Законы Фарадея. Электрохимический эквивалент. Число Фарадея
С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Майклом Фарадеем, который в результате своих исследований установил два закона электролиза.
I закон. Масса mi вещества i, прореагировавшего на электроде электрохимической системы, пропорциональна электрическому заряду q, прошедшему через систему:
mi ~ q; mi = MЭХ i∙q = MЭХ i∙I∙t, (4)
где MЭХi – коэффициент пропорциональности.ю называемой электрохимической эквивалентной массой, г/Кл или г/(А∙ч); I – сила тока, А;
t – время пропуская тока, с; q – электрический заряд, Кл. Из (4) следует, что MЭХ i численно равна массе вещества, прореагировавшего на электроде при пропускании через систему заряда q = 1 Кл.
II закон. При постоянном заряде, прошедшем через электрохимическую систему, массы веществ, прореагировавших на электродах, соотносятся между собой как молярные массы их химических эквивалентов при q = const
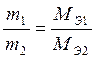 . (5)
. (5)
Второй закон Фарадея применим к веществам, реагирующим:
а) на аноде и катоде одной и той же электрохимической системы;
б) на электродах последовательно соединенных электрохимических систем, для которых I = const, t = const, а, следовательно, и q = const;
в) на электродах любых электрохимических систем при q = const.
Применяя свойство пропорции к (5), можно получить другую формулировку второго закона Фарадея: при постоянном заряде, прошедшем через электрохимическую систему, эквивалентные количества веществ, прореагировавших на электродах, равны между собой:
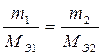 , то есть nЭ1 = nЭ2. (6)
, то есть nЭ1 = nЭ2. (6)
С использованием (4) и (5) выводится следствие из закона Фарадея, устанавливающие пропорциональность электрохимических эквивалентных масс и молярных масс химических эквивалентов веществ:
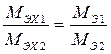 . (7)
. (7)
Из второго закона Фарадея следует, что для электрохимического превращения 1 моль эквивалента вещества необходим постоянный заряд,
F = eNA = 1.6022∙10-19∙6.022∙1023 = 96484 Кл/моль экв = 26.8 А∙ч/моль экв. Для расчетов принимают F = 96500 Кл/моль экв. Постоянная Фарадея равна заряду, переносимому 1 моль элементарных носителей (электронов, однозарядных ионов). Число F представляет собой коэффициент пропорциональности
МЭ i = MЭХ i∙F. (8)
Объединяя уравнения (4) и (8), получают обобщенное выражение законов Фарадея:
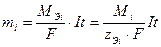 , (9)
, (9)
где Mi – молярная масса вещества, г/моль; zЭi – число эквивалентности, равное заряду катиона металла или числу электронов, принимающих участие в электродном процессе.
В применении к газам, подвергающимся превращению на электродах (выделение при электролизе водорода на катоде, хлора или кислорода на аноде, поглощение кислорода на катоде при электрохимической коррозии), обобщенное выражение законов Фарадея записывают чаще через объемы реагирующих веществ:
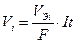 , (9)
, (9)
где Vi – объем выделившегося или поглощенного газа; VЭi – молярный объем химического эквивалента этого газа (при н.у. для О2 – 5.6 л/моль экв, для Н2, Cl2 – 11.2 л/моль экв).
Дата добавления: 2014-12-05; просмотров: 4811;
