Расчет электродного потенциала. Уравнение Нернста
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:
1) от природы веществ – участников электродного процесса;
2) от соотношения между концентрациями этих веществ;
3) от температуры системы.
Значения электродных потенциалов рассчитывают по уравнению Нернста:
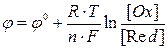 , (1)
, (1)
где 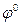 ‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина, К; F – число Фарадея, равное ~96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина, К; F – число Фарадея, равное ~96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
Для металлического электрода уравнение Нернста принимает вид:
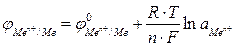 , (2)
, (2)
где n – число электронов, теряемых атомом металла при образовании катиона; 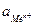 ‑ активность ионов металла в растворе электролита, моль/л.
‑ активность ионов металла в растворе электролита, моль/л.
Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К) и при подстановке значений постоянных величин уравнение (2) принимает вид:
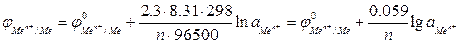 . (3)
. (3)
Дата добавления: 2014-12-05; просмотров: 3116;
