Теоретические аспекты электрохимических процессов
| Түс | 16-лық коды | Түс | 16-лық коды |
| Қара – Black | #000000 | Жасыл – Green | #008000 |
| Күміс түсті – Silver | #С0С0С0 | Ақжасыл – Lime | #00FF00 |
| Сұр – Gray | #808080 | Олив түсті – Olive | #808000 |
| Ақ – White | #FFFFFF | Сары – Yellow | #FFFF00 |
| Қызылқоңыр – Maroon | #800000 | Қаракөк – Navy | #000080 |
| Қызыл – Red | #FF0000 | Көкшіл – Blue | #0000FF |
| Күлгін – Purple | #800080 | Көкжасыл – Teal | #008080 |
| Қызғыш – Fuchsia | #FF00FF | Толқын түсті – Aqua | #00FFFF |
| Қоңыр– Brown | #996633 | Қызғылтсары – Orange | #FF8000 |
| Көкжасыл – Azure | #00FFFF | Қызылкөк– Violet | #8000FF |
Енді ұзындықты өлшеу бірліктерін қарастырайық HTML тілінің ережелеріне сәйкес web-құжат объектілерінің көлемі екі тәсілмен көрсетіледі. Ұзындық нақты пиксель (экранның ең кіші нүктесі) мәнімен немесе негізгі аналық объект (терезенің) көлемінің пайызымен анықталады. Егер бір кесте жасап, оның енін 50% деп жазсақ, онда ол броузер терезесінің 50 пайызын алып тұрады. Ал егер кесте бағанасының ені пайызбен берілсе, ол осы бағана орналасқан кестенің жалпы енінің неше пайызын құрайтынын көрсетеді. Жалпы көрсетілген ұзындық терезе көлемі өзгертілген сәтте ішкі көлем сәйкестіктерін толық сақтап отыруы тиіс. Объект мөлшерін пиксельмен нақты көрсету кезінде алыстағы тұтынушы компьютерінің сипаттамаларының (экрандағы пиксельдер саны) әр түрлі болатынын есепке алып отыру қажет.
Белгілі бір элементтің көлемін пиксельмен беру кезінде оның мүмкін болатын ең кіші мәнін алған дұрыс. Егер бір объектінің ені отыз пиксель болатын болса, оны былайша жазып көрсету керек:
width="30"
Ал оның ені негізгі объекті енінің отыз пайызын құрайтын болса, онда былайша жазу қажет:
width="30%"
Бұл екі тәсілден бөлек тағы бір тәсіл қолданылуы мүмкін. Біз алдыңғы бір көрсетілген пиксельдер мәнін бірнеше есе үлкейтіп пайдалана аламыз. Мысалы, үш жолдан тұратын кесте тұрғыздық делік. Кестенің биіктігі әйтеуір бір тәсілмен тағайындалған болсын. Енді әрбір жолдың биіктігі отыз пиксельге еселеніп (30, 60, 90, ...) берілуі қажет болса, онда әрбір жолды құратын тәгтер параметрлері ретінде мынадай мән жазуымыз керек:
height="3*"
Ұзындық мөлшерінің еселеніп өзгеру белгісі “жұлдызша” (*) символымен көрсетіледі. Жаңа мән есептелуі кезінде жұлдызшаның сол жағындағы сан онға (жиырмаға, отызға,...) көбейтіледі. Броузер осындай объектілерді барынша үлкейтіп бейнелеуге тырысады. Егер кестенің жалпы биіктігі 180 пиксель болатын болса, онда әрбір жол биіктігі 60 пиксель болып тағайындалады. Кесте биіктігі 200 пиксель болса да, осы мәндер алынып, 20 пиксель пайдаланылмай қалады. Егер жолдар биіктігі бірдей болуы керек болса, онда height="*"
болып жазылады. Егер атрибутта екі мән көрсетілетін кездерде, олардың біреуі “жұлдызша” таңбасымен жазылса, онда ол объектінің алғашқысынан қалған бөлігін алып тұрады деген ұғымға сәйкес келеді. Мысалы, фреймдердегі:
cols=”30,*”
деп жазылған атрибут екі бағана түріндегі фрейм ашылып, оның алғашқысының ені 30 пиксель, ал екіншісі терезенің қалған бөлігін алып тұратынын көрсетеді. Жалпы алдын ала келісім бойынша да, мән көрсетілмеген жағдайда осы тәсіл қабылданған.
Теоретические аспекты электрохимических процессов
1.1 Какие процессы называются электрохимическими?
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, в которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций.
В первой группе процессов электрическая энергия превращается в химическую, во второй, наоборот, химическая - в электрическую.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках ток переносят электроны, в растворе электролитов - ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, то есть на границе металл-электролит. На одном электроде происходит процесс приема электронов - восстановление, на втором электроде - процесс отдачи электронов, то есть окисления.
Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
1.2 В чем заключается сущность механизма образования электродного потенциала?
Гальванический элемент (химический источник тока) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух электродов (полуэлементов).
Система, в которой металл погружен в раствор собственной соли, называется электродом или полуэлементом. При погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс – это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы:
Me ⇄ Men+ + n 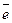
Ионизация происходит под действием полярных молекул растворителя (например, воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис. 1).
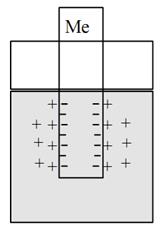
Рис. 1. Схема металлического электрода
Второй процесс – это взаимодействие молекул растворителя с ионами металла, то есть сольватация образующихся ионов:
Men+ + mH2O ⇄ Men+∙mH2O
При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла, но со временем скорость прямой реакции уменьшается, а растет скорость обратной реакции, пока между этими процессами не установится динамическое равновесие:
Me + mH2O ⇄ Men+∙mH2O + n 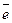
При этом на границе металл-раствор (твердая фаза - жидкость) устанавливается равновесный двойной электрический слой (ДЭС), состоящий из положительных ионов и электронов. Условное обозначение системы металл-раствор – Ме/Меn+, где вертикальной чертой отмечена граница раздела твердая фаза-раствор.
Дата добавления: 2014-12-05; просмотров: 1120;
